
| A、5.8 | B、11.6 | C、23.2 | D、46.4 |
| m |
| M |
| 16g |
| 32g/mol |
| 23.2g |
| 1mol |


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:
| 时间/min | CO | H2O(g) | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | 0.100 | 0.200 | 0.100 | 0.100 |
| 4 | 0.100 | 0.200 | 0.100 | 0.100 |
| 5 | 0.116 | 0.216 | 0.084 | C1 |
| 6 | 0.096 | 0.266 | 0.104 | C2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
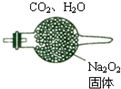 200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比.
200℃时,11.6gCO2和水蒸气的混合气体与足量的Na2O2充分反应后固体质量增加了3.6g(如图所示),其原混合物中CO2和H2O的物质的量比.查看答案和解析>>
科目:高中化学 来源: 题型:
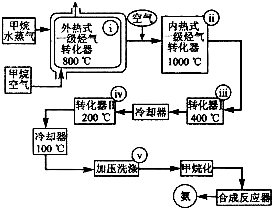 某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如图.该流程中外热式一级烃转化器系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置.内热式一级烃气转 化器系指以H2在装置内燃烧为能量维护一 级烃气转化器所生成的CO与H20(g)反应 生成C02和H2所需1000℃高温的装置.
某工厂以天然气、水蒸气和空气为原料和能源合成氨的流程如图.该流程中外热式一级烃转化器系指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置.内热式一级烃气转 化器系指以H2在装置内燃烧为能量维护一 级烃气转化器所生成的CO与H20(g)反应 生成C02和H2所需1000℃高温的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com