
����Ŀ����ѧ����������������ء��밴Ҫ�ش��������⣺
��1��K2FeO4��һ����Ҫ�ľ�ˮ�����������з����Ƶã�2Fe��OH��3+3Cl2+10KOH ![]() 2K2FeO4+6KCl+8H2O���ڸ÷�Ӧ�У���ԭ����_____������Ӧ����1mol K2FeO4����ʱ������Cl2�ڱ���µ����Ϊ_________ L,ת�Ƶ��ӵ���ĿΪ_____��
2K2FeO4+6KCl+8H2O���ڸ÷�Ӧ�У���ԭ����_____������Ӧ����1mol K2FeO4����ʱ������Cl2�ڱ���µ����Ϊ_________ L,ת�Ƶ��ӵ���ĿΪ_____��
��2���Ա���ù�����������������д�����������������̼��Ӧ�Ļ�ѧ����ʽ����˫���ŷ���ʾ����ת�Ƶķ������Ŀ��_____________________________________________��
��3��������С�մ���������ķ��ݼ���д��С�մ�����ˮ�ĵ��뷽��ʽ:___________��
��4����ҵ����Ư�۵Ļ�ѧ����ʽΪ_______________________________��������ˮ�����������²�����ɫ���壬�÷�Ӧ�Ļ�ѧ����ʽ��______��
��5��KA1(SO4)212H2O��������ˮ����_____(��ѧʽ)�����������ʣ��Ӷ��ﵽ��ˮ���á�
��6����־��кܸߵ�_____����Ҫ������ѹ������о��������ˮ��Һ������Ϊ______������Ϊľ��________________��ԭ�ϡ�
��7�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�塣д��FeCl3��Һ��ͭ������Ӧ�����ӷ���ʽ��________________________________������ʢ���Ȼ�����Һ���ձ���ͬʱ�������ۺ�ͭ�ۣ���Ӧ���������н�������ܳ��ֵ���________��
A����ͭ���� B��������ͭ C������ͭ���� D������ͭ����
���𰸡�Fe��OH��3 33.6 3NA��1.806��1024  NaHCO3===Na����HCO3- 2Cl2+2Ca(OH)2==CaCl2+ Ca(ClO)2+2H2O 2HClO
NaHCO3===Na����HCO3- 2Cl2+2Ca(OH)2==CaCl2+ Ca(ClO)2+2H2O 2HClO![]() 2HCl+O2�� Al��OH��3 ������ ˮ���� ����� Cu��2Fe3��===2Fe2����Cu2�� B
2HCl+O2�� Al��OH��3 ������ ˮ���� ����� Cu��2Fe3��===2Fe2����Cu2�� B
��������
(1).2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O��Ӧ�У�FeԪ�ػ��ϼ���+3����Ϊ+6��������������1mol K2FeO4ת��3mol���ӣ����ݻ�ѧ����ʽ��������1mol K2FeO4���������������
��2�����������������̼��Ӧ����̼���ƺ��������������Ʒ����绯��Ӧ����Ԫ�ػ��ϼ���-1����Ϊ0����-1����Ϊ-2��������=������=ת�Ƶ�������
��3��С�մ���ǿ�����������ˮ����������Ӻ�̼�����������
��4����ҵ�����������ƺ�������Ӧ��Ư�ۣ�������ˮ�������������������ᷢ���ֽⷴӦ����HCl��������
��5��������ˮ���������������������������������������������
��6����ѹ������о��Ҫ�ܺõĵ�������������ˮ��Һ������Ϊˮ�����������ƾ��нϸ��۵㣬����ȼ�գ����Ʊ��轺��ľ�ķ��������Ҫԭ����
��7��FeCl3��Һ��ͭ��Ӧ�����Ȼ�ͭ���Ȼ���������ʢ��FeCl3��Һ���ձ���ͬʱ�������ۺ�ͭ�ۣ�����Fe�Ļ�ԭ�Ա�Cuǿ��Fe3+����Ӧ��Fe��Ӧ�����Fe3+��ʣ�࣬ʣ���Fe3+����Cu��Ӧ��
(1).2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O��Ӧ�У�FeԪ�ػ��ϼ���+3����Ϊ+6��������������Fe(OH)3�ǻ�ԭ��������1mol K2FeO4ת��3mol��������������3NA�����ݻ�ѧ����ʽ������1mol K2FeO4�������������ʵ�����1.5mol���ڱ���µ����Ϊλ1.5mol��22.4L/mol=33.6L��
��2�����������������̼��Ӧ����̼���ƺ���������Ӧ����ʽ��2Na2O2��2CO2 =2Na2CO3��O2���������Ʒ����绯��Ӧ����Ԫ�ػ��ϼ���-1����Ϊ0����-1����Ϊ-2��������=������=ת�Ƶ���������˫���ŷ���ʾ����ת�Ƶķ������ĿΪ ��
��
��3��С�մ�̼��������ǿ�����������ˮ����������Ӻ�̼��������������뷽��ʽ��NaHCO3=Na����HCO3-��
��4����ҵ�����������ƺ�������Ӧ��Ư������Ӧ����ʽ��2Cl2+2Ca(OH)2==CaCl2+ Ca(ClO)2+2H2O��������ˮ�������������������ᷢ���ֽⷴӦ�����������������Ӧ����ʽ��2HClO ![]() 2HCl+O2����
2HCl+O2����
��5��������ˮ������Al(OH)3������Al(OH)3�����������������
��6����Ϊ��־��кܸߵĵ����ԣ�������Ҫ������ѹ������о��������ˮ��Һ������Ϊˮ����������Ϊľ�ķ������ԭ����
��7��FeCl3��Һ��ͭ��Ӧ�����Ȼ�ͭ���Ȼ���������Ӧ�����ӷ���ʽ��Cu��2Fe3��=2Fe2����Cu2������������ͭ�Ļ������������Ȼ�����Ӧ��������ȫ����Ӧ��ͭ��ʣ�࣬�ʲ�ѡA����������ͭ�Ļ������������Ȼ�����Ӧ������Ӧ���ͭ���ܲμӷ�Ӧ���������������ͭ�����Σ���ѡB�����Ȼ��������٣���������ۺ�ͭ�۶�����ʣ�࣬�ʲ�ѡC;���Ȼ��������࣬��������ۺ�ͭ��ȫ���μӷ�Ӧ����������ʣ�࣬�ʲ�ѡD����ΪB��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ݷ��������������ſ�Ԥ���л�����������ʡ�
�� ���л��������ܷ�����ȥ��Ӧ����_________(����ĸ)��
a��CH3OH b��CH3CH2Cl c��HC��CH
�� ���л������У��������ܱ�������������_________(����ĸ)��
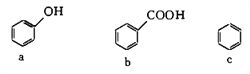
�� ���л������У��ܷ���ˮ�ⷴӦ����_________(����ĸ)��
a��H2C=CH2 b��CH3COOCH2CH3 c��CH3CH2OH
��2���ױ�(![]() )��һ����Ҫ���л�����ԭ�ϡ�
)��һ����Ҫ���л�����ԭ�ϡ�
�� �ױ�������һ����ƽ���̼ԭ����________����
�� �ױ������ϵ�һ�������______�֣���д������һ�ֵ����ƣ�_________��
�� ��ȥ�ױ��л��е��������ӣ���ѡ�õ��Լ���_________��д���÷�Ӧ�Ļ�ѧ����ʽ��__________��
��3��������C��һ��ҽҩ�м��壬��ͨ�����з����ϳɣ�
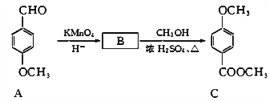
�� A�к��������ŵ�����Ϊ_________��_________��
�� B�Ľṹ��ʽΪ_________��
�� B��C�ķ�Ӧ����Ϊ__________��
�� C��ͬ���칹��D�ܷ���������Ӧ������FeCl3��Һ������ɫ��Ӧ����1 mol D�������2 mol NaOH��Ӧ��D��������4�ֲ�ͬ��ѧ�������⣬��д��D��һ�ֽṹ��ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ҵ�(C2H5OH)�������������( )
A.�׳ƾƾ�B.����������Ʒ�Ӧ
C.�����ܼ�D.�������ᷢ��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ���dz��������巢��װ�ã������������������ռ�װ�ã�����Ҫ��ش��������⣺
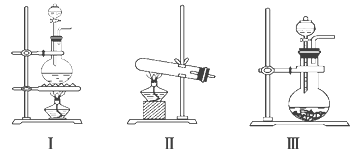
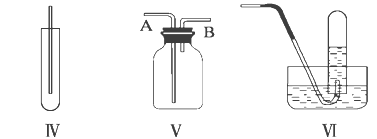
(1)����MnO2��Ũ���ᷴӦ��ȡ������Ӧѡ�÷���װ��_____���÷���ʽ��ʾ��ȡ�����ķ�Ӧԭ����______��
(2)����KMnO4��Ũ���ᷴӦ��ȡ����������ɲ���ƽ�������ӷ���ʽ��
____MnO42-��____Cl����____H��===____Mn2����____Cl2����____________��
(3)��ѡ����Ϊ�������ռ�װ�ã�Ӧ�����Թܿڷ���һ������������Ӧ��________��Һ��ʪ����������____________��
(4)��ѡ����Ϊ�����ռ�װ�ã�������Ӧ��__________��ͨ�롣�û�ѧ�������������ռ����˵ķ�����_______��
(5)��ѧ�Ҿ��о�����NaClO2��������ȡ����ˮ������ClO2����һ�������£���Cl2ͨ������й���NaClO2�ķ�Ӧ���ڶ��߷�Ӧ���Ƶ�ClO2����ԭ����Ϊ_____�������ı�״����1.12L Cl2 ʱ���Ƶ�ClO2_____g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У����ȵ����ʵ�����NaHCO3��Na2O2�Ĺ��������ַ�Ӧ�������й���ʣ������( )
A. Na2CO3��Na2O2 B. Na2CO3��NaOH
C. NaOH��Na2O2 D. NaOH��Na2O2��Na2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����SO2����ͨ��BaCl2��Һ�У�û�п�������������ͨ��һ�����壨�����һ�����ʣ��ɲ���һ�ְ�ɫ�����������壨�����ʣ��������ǣ�������
A.Cl2
B.NH3
C.CO2
D.FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����( )
A.�������ô���ˮ���������彡��
B.���ڷ��ð�˾ƥ�ֿ���Ԥ��ijЩ������û�и�����
C.����Ȼ���ʶ�����ɫ��������
D.����ʳ�û����ͱ����������ڽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�NaClO��Һ��KI��Һ�ķ�Ӧ��ʵ���¼���£�
ʵ���� | ʵ����� | ʵ������ |
�� |
| ������Һ��Ϊdz��ɫ ������Һ���� |
�� |
| ������Һ������ɫ ������Һ����������Һ��pH=10 |
������������Ļ�������Ҫ��I��IO3����ʽ����������������IO3��������Cl����������I��ClO��pH<4�����ȵ������¼����ȶ���
��1��0.5 mol��L1 NaClO��Һ��pH��11�������ӷ���ʽ��ʾ��ԭ����______��
��2��ʵ��������Һ��Ϊdz��ɫ�����ӷ���ʽ��______��
��3���Ա�ʵ�����͢��о�ʵ������Ӧ������Һ����������ԭ��
�� �������a��I2�ڼ�����Һ�в��ܴ��ڡ����ʵ����֤ʵ�˼���a������ʵ���IJ�����������______��
�� ��һ���������b��NaClO�ɽ�I2����ΪIO3������ʵ��֤ʵ�˼���b������װ������ͼ�����м���Һ��______��ʵ��������______��

��4������ʵ���������Һ�е�IO3��
ȡʵ����������Һ���μ�ϡ�������������������̾�δ������ɫ��һ��ʱ����л���ɫ�̼�����ζ����������������Һ��pH��2���ټ���KI��Һ����Һ������˵��ʵ����������Һ�д���IO3��
�� �����Ļ���ɫ������______��
�� ��ͬѧ��Ϊ��ʵ�鲻��˵��ʵ���������Һ�д���IO3��������______����֤��ʵ����������Һ�д���IO3���Ľ���ʵ�鷽����______��
�� ʵ�����з�Ӧ�����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤��CH3COOH��������ʵ�ʵ����ʵ�ǣ� ��
A. CH3COONa��Һ�Լ���
B. 0.1mol/LCH3COOH��ҺpH>1
C. ��CH3COOH��Һ����ˮ���е�ˮ��,�ɽ������
D. 25��ʱ,0.1mo/LCH3COOH��Һ��0.1mol/LHCl��Һ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com