
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
【答案】 ClO + H2O![]() OH + HClO ClO + 2I + H2O == I2 + Cl + 2OH 向pH=10的NaOH溶液中加入少量滴有淀粉溶液的碘水,振荡,蓝色褪去 碘水 右侧碘水棕黄色变浅,电流表的指针偏转 Cl2 溶液中的Cl2或HClO也可将I氧化为I2,使溶液变蓝 加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液 3ClO + I == 3Cl + IO3
OH + HClO ClO + 2I + H2O == I2 + Cl + 2OH 向pH=10的NaOH溶液中加入少量滴有淀粉溶液的碘水,振荡,蓝色褪去 碘水 右侧碘水棕黄色变浅,电流表的指针偏转 Cl2 溶液中的Cl2或HClO也可将I氧化为I2,使溶液变蓝 加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液 3ClO + I == 3Cl + IO3
【解析】(1)NaClO为强碱弱酸盐,水解显碱性,离子方程式:ClO + H2O![]() OH + HClO;正确答案: ClO + H2O
OH + HClO;正确答案: ClO + H2O![]() OH + HClO。
OH + HClO。
(2)次氯酸钠具有强氧化性,能够把碘离子氧化为碘单质,碘水溶液显黄色,离子方程式是ClO + 2I + H2O == I2 + Cl + 2OH;正确答案:ClO + 2I + H2O == I2 + Cl + 2OH。
(3)①碘与淀粉溶液相遇变为蓝色,向变蓝的溶液中加入pH=10的NaOH溶液,I2与碱性溶液发生反应,碘反应完全后,蓝色溶液褪去;正确答案:向pH=10的NaOH溶液中加入少量滴有淀粉溶液的碘水,振荡,蓝色褪去。
② 根据NaClO可将I2氧化为IO3,以及左侧烧杯中盛放次氯酸钠溶液可知,甲溶液为碘水,此装置为原电池,右侧为原电池的负极,发生氧化反应,I2氧化为IO3,所以碘水棕黄色变浅,电流表的指针偏转 ;正确答案:碘水;右侧碘水棕黄色变浅,电流表的指针偏转。
(4)①氯气为黄绿色气体,所以产生的黄绿色气体是氯气;正确答案: Cl2 。
②碘离子具有还原性,溶解在水中的氯气或氯气与水反应产生的次氯酸都能将I氧化为I2,使溶液变蓝;若证明实验Ⅱ所得溶液中存在IO3,就应该避免氯气或次氯酸的干扰,因此可以采用加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液,来验证结论;正确答案:溶液中的Cl2或HClO也可将I氧化为I2,使溶液变蓝; 加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液 。
③次氯酸根离子具有氧化性,能够把碘离子氧化为碘单质,实验Ⅱ中反应的离子方程式是3ClO + I == 3Cl + IO3;正确答案:3ClO + I == 3Cl + IO3。


科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活密切相关。请按要求,回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH ![]() 2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有1mol K2FeO4生成时,消耗Cl2在标况下的体积为_________ L,转移电子的数目为_____。
2K2FeO4+6KCl+8H2O。在该反应中,还原剂是_____,当反应中有1mol K2FeO4生成时,消耗Cl2在标况下的体积为_________ L,转移电子的数目为_____。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式并用双线桥法表示电子转移的方向和数目:_____________________________________________。
(3)厨房里小苏打常作面包和糕点的发泡剂,写出小苏打溶于水的电离方程式:___________。
(4)工业上制漂白粉的化学方程式为_______________________________,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是______。
(5)KA1(SO4)212H2O因其溶于水生成_____(化学式)可以吸附杂质,从而达到净水作用。
(6)硅钢具有很高的_____,主要用作变压器的铁芯;硅酸钠水溶液的俗名为______,可作为木材________________的原料。
(7)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式:________________________________。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是________。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,当反应aA(g) ![]() bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质间反应的离子反应方程式:
(1)NaHSO4溶液与NaHCO3溶液混合:____________________;
(2)Mg(OH)2固体溶于足量盐酸溶液:_____________________;
(3)向![]() 溶液中加入少量NaOH溶液,反应的离子方程式:_____________;
溶液中加入少量NaOH溶液,反应的离子方程式:_____________;
(4)向![]() 溶液中加入足量NaOH溶液,反应的离子方程式:____________。
溶液中加入足量NaOH溶液,反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空.
(1)标准状况下11.2L![]() 中含______个电子.
中含______个电子.
(2)4.8gCH4中所含氢原子数与______g水所含氢原子数相等.
(3)12.4gNa2R含Na+0.4mol,则Na2R中R原子的摩尔质量为______。
(4)标况下,一定量的N2与22.4LCO所含电子的物质的量相等,则N2的质量是______g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示人体细胞内有机物的元素组成,①②③代表由单体连接成的多聚体。 回答下列问题:
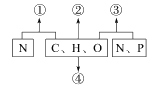
(1)①和②分别为______和______,其中①的单体的结构通式是 ______。
(2)③包括______和______两类,它们在细胞中的分布情况是 ____________。
(3)④可代表脂肪,脂肪有很多重要作用,“胖子怕热,瘦子怕撞”反映出脂肪的作用是 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
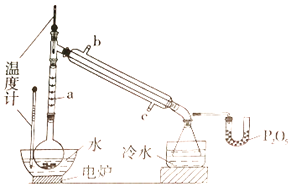
【题目】硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:
硼酸三甲酯 | 甲醇 | |
溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
沸点/℃ | 68 | 64 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
Na2B4O7·10H2O+2H2SO4+16CH3OH![]() 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为____________;直形冷凝管冷却水应从____________(填“b”或“c”)接口进入。
(2)本实验加热方式为____________,优点是____________。
(3)加入氯化钙盐析分层的主要目的是____________。
(4)U型管中P2O5的作用是_____________________________________。
(5)步骤④的仪器选择及安装都正确的是____________ (填标号),应收集____________℃的馏分。


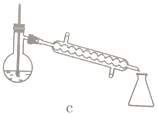
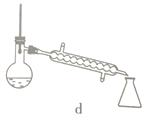
(6)本次实验的产率是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知苯可以进行如下转化:
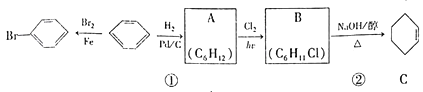
(1)反应①的反应类型为_________,化合物C的化学名称为_________。
(2)B转化为C的方程式为_________________________________________。
(3)如何仅用水鉴别苯和溴苯__________________________________________。
(4)写出苯的同分异构体结构简式(至少写两种)____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com