
【题目】按要求写出下列物质间反应的离子反应方程式:
(1)NaHSO4溶液与NaHCO3溶液混合:____________________;
(2)Mg(OH)2固体溶于足量盐酸溶液:_____________________;
(3)向![]() 溶液中加入少量NaOH溶液,反应的离子方程式:_____________;
溶液中加入少量NaOH溶液,反应的离子方程式:_____________;
(4)向![]() 溶液中加入足量NaOH溶液,反应的离子方程式:____________。
溶液中加入足量NaOH溶液,反应的离子方程式:____________。
【答案】H+ + HCO3- = H2O + CO2↑ Mg(OH)2 + 2H+ = 2H2O + Mg2+ Ca2+ + HCO3- + OH- = H2O + CaCO3↓ Ca2+ + 2HCO3- + 2OH- = CO32- + 2H2O + CaCO3↓
【解析】
根据离子方程式的书写步骤进行,特别注意反应物的相对用量。
(1)水溶液中,NaHSO4=Na++H++SO42-,NaHCO3=Na++HCO3-。则两溶液混合时H+ + HCO3- = H2O + CO2↑;
(2)Mg(OH)2固体不溶于水,溶于足量盐酸Mg(OH)2 + 2H+ = 2H2O + Mg2+;
(3)因HCO3- + OH- = CO3 2-+H2O,则有CaCO3沉淀生成。又NaOH溶液少量,则有剩余HCO3-,生成NaHCO3。故![]() 溶液中加入少量NaOH溶液的离子方程式Ca2+ + HCO3- + OH- = H2O + CaCO3↓;
溶液中加入少量NaOH溶液的离子方程式Ca2+ + HCO3- + OH- = H2O + CaCO3↓;
(4)当NaOH溶液足量时, HCO3- 完全反应,生成 CaCO3和Na2CO3。反应的离子方程式Ca2+ + 2HCO3- + 2OH- =CaCO3↓ +CO32- + 2H2O 。


科目:高中化学 来源: 题型:
【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。

(1)③的操作名称是________________,⑤的操作名称是__________________。
(2)试剂b可以是四氯化碳,还可以是_________________________(填名称)。
(3)关于⑤的操作步骤,下列说法正确的是_____________________(填字母)。
A. 振荡液体时,需要倒转分液漏斗
B. 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C. 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D. 分液时,需要塞进分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:___I― +____H2O2+______==____I2+______。(系数为“1”时,要写“1”)
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
熔点 | 沸点 | |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,图中有一个明显错误,应改正为_______________________________________。
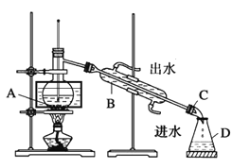
②该小组同学改正装置错误后,进行实验。用80℃水浴加热片刻,观察到烧瓶中出现紫色蒸气,锥形瓶中也开始收集到浅紫红色溶液,最终烧瓶中残留少量的I2。通过实验得出结论,常压下的蒸馏__________________________(填“适合”或“不适合”)分离I2和CCl4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.长期饮用纯净水有益于人体健康
B.长期服用阿司匹林可以预防某些疾病,没有副作用
C.纯天然物质都是绿色无毒的物质
D.长期食用花生油比猪油更有利于健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。已知:NH4HCO3![]() NH3↑+H2O+CO2↑。某学生设计了如下方案:
NH3↑+H2O+CO2↑。某学生设计了如下方案:

![]()
![]()
请回答下列问题:
(1)步骤①加热的目的是_____。
(2)写出步骤②中发生的离子方程式_____。
(3)步骤②,判断SO42-已除尽的方法是_______________________________________。
(4)步骤③的目的是_____,操作1用到的玻璃仪器有_____。
(5)操作2的名称是_____,应在_____(填仪器名称)中进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关CuSO4溶液的叙述不正确的是( )
A. 通入CO2气体产生蓝色沉淀
B. 通入H2S气体产生黑色沉淀
C. 与适量浓氨水反应:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
D. 电解精炼铜时用CuSO4和H2SO4的混合液作电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A.FeCl3=Fe2++3Cl﹣
B.NaOH=Na++OH﹣
C.H2SO4=H2++SO42﹣
D.NaHCO3=Na++H++CO32﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com