
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。已知:NH4HCO3![]() NH3↑+H2O+CO2↑。某学生设计了如下方案:
NH3↑+H2O+CO2↑。某学生设计了如下方案:

![]()
![]()
请回答下列问题:
(1)步骤①加热的目的是_____。
(2)写出步骤②中发生的离子方程式_____。
(3)步骤②,判断SO42-已除尽的方法是_______________________________________。
(4)步骤③的目的是_____,操作1用到的玻璃仪器有_____。
(5)操作2的名称是_____,应在_____(填仪器名称)中进行。
【答案】加热分解除去NH4HCO3 Ba2++SO42-=BaSO4↓ 取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽 除去过量的Ba2+ 漏斗、玻璃棒、烧杯 蒸发结晶 蒸发皿
【解析】
将固体混合物加热,发生反应NH4HCO3![]() NH3↑+H2O+CO2↑,NaCl、Na2SO4不反应,则残留固体为NaCl、Na2SO4,将残留固体溶解得到NaCl、Na2SO4溶液,向溶液中加入BaCl2溶液发生反应生成硫酸钡沉淀,向悬浊液中再加入Na2CO3溶液除去过量的钡离子,过量的Na2CO3用盐酸除去,而盐酸易挥发,在操作2即可除去,然后蒸发浓缩冷却结晶得到NaCl晶体,据此解答。
NH3↑+H2O+CO2↑,NaCl、Na2SO4不反应,则残留固体为NaCl、Na2SO4,将残留固体溶解得到NaCl、Na2SO4溶液,向溶液中加入BaCl2溶液发生反应生成硫酸钡沉淀,向悬浊液中再加入Na2CO3溶液除去过量的钡离子,过量的Na2CO3用盐酸除去,而盐酸易挥发,在操作2即可除去,然后蒸发浓缩冷却结晶得到NaCl晶体,据此解答。
(1)碳酸氢铵受热易分解,则步骤①加热的目的是加热分解除去NH4HCO3;
(2)步骤②用BaCl2溶液,目的是除去硫酸根离子,反应的离子方程式为Ba2++SO42-=BaSO4↓;
(3)由于硫酸钡是不溶于水也不溶于酸的白色沉淀,则步骤②判断SO42-已除尽的方法是取上层清液加入BaCl2溶液,若无沉淀说明SO42-已除尽;
(4)由于除去硫酸根离子时引入了过量的氯化钡,因此步骤③的目的是利用碳酸钠除去过量的Ba2+,操作1是过滤,用到的玻璃仪器有漏斗、玻璃棒、烧杯;
(5)氯化钠能溶于水,从溶液中得到氯化钠的实验操作是蒸发结晶,应在蒸发皿中进行。


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
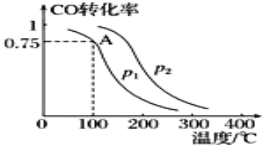
(1)p1___p2(填“>”、“<”或“=”),理由是___.
(2)该甲醇合成反应在A点的平衡常数K=___(用a和V表示).
(3)该反应达到平衡时,反应物转化率的关系是CO___H2.(填“>”、“<”或“=”)
(4)下列措施中能够同时满足增大反应速率和提高CO转化率的是___(填字母).
A. 使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OH从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组对反应2X (g) + Y(g)2Z(g)进行对照实验(见下表)。下列有关说法错误的是( )
实验序号 | 反应温度 | c(X)mol/L | c(Y)mol/L |
1 | 400℃ | 2 | 1 |
2 | 400℃ | 2 | 2 |
A.该反应为可逆反应B.探究温度对反应速率的影响
C.探究浓度对反应速率的影响D.实验2的反应速率较快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如下装置进行实验①和②,在相同时间内,记录现象如下(溶液的温度变化均不明显)。
实验装置 | 实验序号 | 电极材料 | 实验现象 |
| ① | 铂 | 两极均产生大量无色气泡, 两极区的溶液均未见白色浑浊 |
② | 石墨 | 两极均产生大量无色气泡, 阴极区未见白色浑浊, 阳极区产生白色浑浊,分离出该白色固体,加酸溶解,产生气泡 |
根据实验现象,下列说法正确的是
A. ①②中,阴极的电极反应式:2H2O-4e == O2↑+ 4H+
B. ②中,白色浑浊的主要成分是Ca(OH)2
C. ②中,产生白色浑浊的主要原因是电解过程消耗水
D. ②中,产生白色浑浊与阳极材料被氧化生成CO32有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列物质间反应的离子反应方程式:
(1)NaHSO4溶液与NaHCO3溶液混合:____________________;
(2)Mg(OH)2固体溶于足量盐酸溶液:_____________________;
(3)向![]() 溶液中加入少量NaOH溶液,反应的离子方程式:_____________;
溶液中加入少量NaOH溶液,反应的离子方程式:_____________;
(4)向![]() 溶液中加入足量NaOH溶液,反应的离子方程式:____________。
溶液中加入足量NaOH溶液,反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)配平下列化学方程式或离子方程式:
![]() ______MnO2 + ______HC1(浓)Δ_ ____MnCl2 +_____
______MnO2 + ______HC1(浓)Δ_ ____MnCl2 +_____![]() ______
______![]() _________
_________
![]() _____
_____![]() ____
____![]() ____H2O -----_____
____H2O -----_____![]() ____
____![]() __ _____ _________
__ _____ _________
(2)用双线桥表示出下列反应中电子转移方向和数目
①3S + 6KOH = 2K2S + K2SO3 + 3H2O___________
②KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
A. pH=9 B. c(OH-)≈10-5mol·L-1
C. pH≈7 D. c(OH-)<10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别为生物体内生物大分子的部分结构模式图,据图回答下列问题。


丙
(1)图甲中的三种物质都是由许多__________连接而成的。这三种物质中,在功能上与另外两种截然不同的是__________,这种物质参与细胞中__________的构成。淀粉的水解产物可用___________试剂鉴定.
(2)图乙所示化合物的基本组成单位可用图中字母_________表示。
(3)图丙中化合物的含有肽键________个,含______种氨基酸,鉴定该化合物的试剂是____________,现象是________________
(4)图丙中化合物若要形成环状肽,可再发生化学反应的基团编号是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com