
【题目】(1)配平下列化学方程式或离子方程式:
![]() ______MnO2 + ______HC1(浓)Δ_ ____MnCl2 +_____
______MnO2 + ______HC1(浓)Δ_ ____MnCl2 +_____![]() ______
______![]() _________
_________
![]() _____
_____![]() ____
____![]() ____H2O -----_____
____H2O -----_____![]() ____
____![]() __ _____ _________
__ _____ _________
(2)用双线桥表示出下列反应中电子转移方向和数目
①3S + 6KOH = 2K2S + K2SO3 + 3H2O___________
②KClO3 + 6HCl = KCl + 3Cl2↑ + 3H2O_________
【答案】1, 4 ,1 ,1, 2 2, 5, 2, 2, 5, 4H+ 

【解析】
根据氧化还原反应中化合价的变化,利用化合价升降总数相等(或得失电子总数相等)配平氧化还原反应、表示电子转移方向和数目。
(1)![]() MnO2 →MnCl2 锰元素化合价降低2,2HC1→Cl2 氯元素化合价升高1×2。即配平后MnO2、MnCl2 、Cl2 的化学计量数都是1,作还原剂的HC1为2。据MnCl2,另有2HC1作为酸参与反应,故最终HC1的化学计量数为4。又氢或氧原子守恒得H2O的化学计量数为2。
MnO2 →MnCl2 锰元素化合价降低2,2HC1→Cl2 氯元素化合价升高1×2。即配平后MnO2、MnCl2 、Cl2 的化学计量数都是1,作还原剂的HC1为2。据MnCl2,另有2HC1作为酸参与反应,故最终HC1的化学计量数为4。又氢或氧原子守恒得H2O的化学计量数为2。
②MnO4-→Mn2+锰元素化合价降低5,SO2→SO42-硫元素化合价升高2,其它元素化合价不变。要使化合价升降总数相等,MnO4-、Mn2+的化学计量数配2,SO2、SO42-的化学计量数配5。要使氧原子守恒,H2O的化学计量数配2。要使氢原子守恒、电荷守恒,应生成4H+。
(2)①反应中,2S → 2K2S硫原子共得4e-,另S→ K2SO3 硫原子失4e-。用双线桥表示为:

②据化合价归中规律,反应中KClO3 →![]() Cl2氯原子得5e-, 5HCl→
Cl2氯原子得5e-, 5HCl→![]() Cl2氯原子失5e-,另一个HCl(酸)→ KCl。用双线桥表示为:
Cl2氯原子失5e-,另一个HCl(酸)→ KCl。用双线桥表示为:


科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为能减少环境污染的是( )
A.含氮、磷化合物的废水大量排放B.农业生产中农药、化肥的大量使用
C.实现煤的清洁利用,大力开发新能源D.使用含有甲醛、氡等的材料装修房子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。已知:NH4HCO3![]() NH3↑+H2O+CO2↑。某学生设计了如下方案:
NH3↑+H2O+CO2↑。某学生设计了如下方案:

![]()
![]()
请回答下列问题:
(1)步骤①加热的目的是_____。
(2)写出步骤②中发生的离子方程式_____。
(3)步骤②,判断SO42-已除尽的方法是_______________________________________。
(4)步骤③的目的是_____,操作1用到的玻璃仪器有_____。
(5)操作2的名称是_____,应在_____(填仪器名称)中进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学利用下图装置对电化学原理进行了一系列探究活动。

(1)甲池为装置_______(填“原电池”或“电解池”)。
(2)甲池反应前,两电极质量相等,一段时间后,两电极质量相差28g,导线中通过_________mol电子。
(3)实验过程中,甲池左侧烧杯中NO3-的浓度_______(填“变大”、“变小”或“不变”)。
(4)其他条件不变,若用U形铜棒代替“盐桥”,工作一段时间后取出铜棒称量,质量___________(填“变大”、“变小”或“不变”)。若乙池中的某盐溶液是足量AgNO3溶液,则乙池中左侧Pt电极反应式为___________________________________,工作一段时间后,若要使乙池溶液恢复原来浓度,可向溶液中加入_____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A(g)和B,发生反应:xA(g)+2B(s) ![]() yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
yC(g) △H<0.在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。
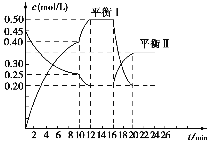
请回答下列问题
(1)根据图示可确定x:y=________。
(2)0-10min容器内压强______ (填“变大”、“ 不变”或“变小”)
(3)推测第10min引起曲线变化的反应条件可能是______(填编号,下同);第16min引起曲线变化的反应条件可能是________。
①减压 ② 增大A的浓度 ③增大C的量 ④升温 ⑤ 降温⑥ 加催化剂
(4)若平衡1的平衡常数为K1,平衡II的平衡常数为K2,则K1______(填“>”“=”或“<”)K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)![]() H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:

①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4-![]() 2HC2O4-的平衡常数的对数值1gK=____________。
2HC2O4-的平衡常数的对数值1gK=____________。
(3)向10mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)____________10mL(填“>”“=”或“<”)。
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是____________;该过程中发生反应的离子方程式为____________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是
A. Na2CO3 + CaCl2=CaCO3 ↓ + 2NaCl B. Cl2 + 2KI=2KCl + I2
C. 2NaHCO3 ![]() Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
Na2CO3 + CO2 ↑ + H2O D. CaO + H2O=Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com