
����Ŀ������CO��H2���Ժϳɼ״�,��Ӧԭ��ΪCO(g)+2H2(g)�TCH3OH(g).һ��������,���ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
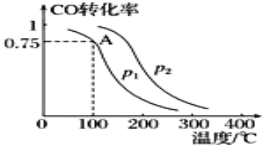
��1��p1___p2(�>������<����=��)��������___.
��2���ü״��ϳɷ�Ӧ��A���ƽ�ⳣ��K=___(��a��V��ʾ).
��3���÷�Ӧ�ﵽƽ��ʱ,��Ӧ��ת���ʵĹ�ϵ��CO___H2.(�>������<����=��)
��4�����д�ʩ���ܹ�ͬʱ��������Ӧ���ʺ����COת���ʵ���___(����ĸ).
A. ʹ�ø�Ч���� B.���ͷ�Ӧ�¶�
C. ������ϵѹǿ D.���Ͻ�CH3OH�ӷ�Ӧ������з������
���𰸡� < �״��ĺϳɷ�Ӧ�Ƿ��������ٵķ�Ӧ����ͬ�¶��£�����ѹǿCO��ת������� 12V2 / a2 = C
��������(1)�״��ĺϳɷ�Ӧ�Ƿ��������ٵķ�Ӧ����ͬ�¶��£�����ѹǿ��ƽ��������Ӧ�����ƶ�����CO��ת����������ͼ��֪��p1��p2���ʴ�Ϊ�������״��ĺϳɷ�Ӧ�Ƿ��������ٵķ�Ӧ����ͬ�¶��£�����ѹǿCO��ת������ߣ�
(2)����ͼ��֪����A�㣬CO��ת����Ϊ0.75������ƽ��ʱn(CO)=amol��(1-0.75)=0.25amol��n(CH3OH)=c(CO)(�μӷ�Ӧ)=amol��0.5=0.75amol��n(H2)=2amol-2��amol��0.75=0.5amol����c(CO)= ![]() mol/L��c(CH3OH)=
mol/L��c(CH3OH)= ![]() mol/L��c(H2)=
mol/L��c(H2)= ![]() mol/L������K=
mol/L������K=![]() =
=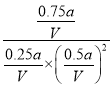 =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
(3)��Ӧ�������֮�ȵ��ڷ�Ӧ����ʽ�е�ϵ��֮�ȣ������ַ�Ӧ��ת������ȣ��÷�Ӧ�з�Ӧ��CO ��H2��ϵ��֮��Ϊ1��2������Ͷ�������֮�ȣ�����CO ��H2��ת������ȣ��ʴ�Ϊ��=��
(4)a��ʹ�ø�Ч��������Ӧ���ʼӿ죬��ƽ�ⲻ�ƶ����ʲ�ѡ��b�����ͷ�Ӧ�¶ȣ���Ӧ���ʼ������ʲ�ѡ��c��������ϵѹǿ����Ӧ���ʼӿ죬ƽ�������ƶ���CO��ת��������ѡ��d�����Ͻ�CH3OH�ӷ�Ӧ������з����������Ӧ���ʼ������ʲ�ѡ���ʴ�Ϊ��C��


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ����
A.NaOH��ҺB.KCl��ҺC.Fe(OH)3����D.K2SO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը����Ϊԭ�ϣ��õ�ⷨ�Ʊ��ظ���ص�ʵ��װ����ͼ������˵������ȷ����

A. �������ң������ĵ缫��ӦΪ��2H2O+2e-=2OH-+H2��
B. �������ң�ͨ�����Һ���ɻ�ɫ��Ϊ��ɫ������Ϊ������H+Ũ������ʹƽ��2CrO42-+2H+ Cr2O72-+H2O�����ƶ�
C. ���Ʊ������ܷ�Ӧ�Ļ�ѧ����ʽΪ��4K2CrO4+4H2O![]() 2K2Cr2O4+4KOH+2H2��+O2��
2K2Cr2O4+4KOH+2H2��+O2��
D. �ⶨ����Һ��K��Cr�ĺ�������K��Cr�����ʵ���֮��Ϊd�����ʱ����ص�ת����Ϊ2-d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
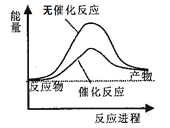
A. ��ͼ�ɱ�ʾˮ�ֽ�����е������仯
B. ��2C(s)+O2(g)=2CO(g)��=221.0kJ/mol����̼��ȼ����Ϊ110.5kJ/mol
C. ��Ҫ���ȵķ�Ӧһ�������ȷ�Ӧ���������ܷ����ķ�Ӧһ���Ƿ��ȷ�Ӧ
D. ��֪I:��ӦH2(g)+Cl2(g)=2HCl(g)��=akJ/mol��II:![]() ��a��b��c��������,��Ͽ�1mol HCl�����������Ϊ(abc)kJ/mol
��a��b��c��������,��Ͽ�1mol HCl�����������Ϊ(abc)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����ȡ����Ӧ����( )
A.����ȼ�����ɶ�����̼��ˮ
B.�Ҵ���������Ӧ������ȩ
C.��ϩ���巴Ӧ����1,2-��������
D.������������Ӧ����һ�ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������д����ĵ⣬ÿ1000g�����к���5g���ҡ�ʵ�����У��Ӻ�������ȡ��IJ�����������ͼ��

(1)�۵IJ���������________________���ݵIJ���������__________________��
(2)�Լ�b���������Ȼ�̼����������_________________________(������)��
(3)���ڢݵIJ������裬����˵����ȷ����_____________________(����ĸ)��
A. ��Һ��ʱ����Ҫ��ת��Һ©��
B. �����Һ�����Һ©������������̨�ϣ�������Һ
C. ��Һʱ�����²�Һ�嶼Ҫ�ӷ�Һ©���¿������ձ��ڱ����벻ͬ���ձ�
D. ��Һʱ����Ҫ������Һ©���Ϸ��IJ�������ʹ��Һ©���ܷ�
(4)�Լ�a��ѡ��ϡ�����ữ�Ĺ���������Һ����ȫ����ܷ�Ӧ�����ӷ���ʽ��___I�D +____H2O2+______==____I2+______��(ϵ��Ϊ��1��ʱ��Ҫд��1��)
(5)ij��ȤС�����ʵ�鷽�����Ӻ�I2��CCl4��Һ�з���I2��CCl4����֪��
�۵� | �е� | |
I2 | 114�� | 184�� |
CCl4 | -23�� | 77�� |
��С��ͬѧ�������ϣ�����������ķ�������װ������ͼװ�ã�����B��������_____��ͼ����һ�����Դ���Ӧ����Ϊ_______________________________________��
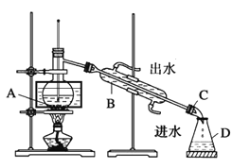
�ڸ�С��ͬѧ����װ�ô������ʵ�顣��80��ˮԡ����Ƭ�̣��۲쵽��ƿ�г�����ɫ��������ƿ��Ҳ��ʼ�ռ���dz�Ϻ�ɫ��Һ��������ƿ�в���������I2��ͨ��ʵ��ó����ۣ���ѹ�µ�����__________________________(�����ʺ����������ʺ���)����I2��CCl4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������Fe��FeO��Fe2O3��Fe3O4�Ļ�����м���150 mL 4 mol��L��1��ϡ����ǡ��ʹ�������ȫ�ܽ⣬�ų�2.24 L NO(��״��)����������Һ�м���KSCN��Һ����Ѫ��ɫ���֡�����������H2�ڼ��������»�ԭ��ͬ�����Ļ������õ����������ʵ���Ϊ(����)
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�������ǹ�������ձ��ע�����⡣
��1��CO2�ĵ���ʽ��______��
��2��CO2�ڴ��������¿���ֱ��ת��Ϊ�Ҷ����ͼ״���������Ӧ�¶ȹ��ߣ��Ҷ�������ȼ��������Ҵ���
![]()
��ȡ�Ҷ����ķ�Ӧ���̿ɷ�Ϊ����2����
��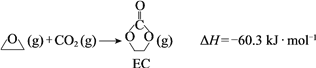
��EC���������Ҷ�����״�
![]()
�� ���������Ȼ�ѧ����ʽ��______��
�� �о���Ӧ�¶ȶ�EC�����Ӱ�죨��Ӧʱ���Ϊ4Сʱ����ʵ�����ݼ��±���
��Ӧ�¶�/ �� | ECת����/ % | ����/ % | |
�Ҷ��� | �״� | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
���ϱ���֪���¶�Խ����EC��ת����Խ����ԭ����______���¶����ߵ�220 ��ʱ���Ҷ����IJ��ʷ������ͣ�ԭ����______��
��3����ϡ�������������Һ�����CO2����ȡ�״���װ������ͼ��ʾ���缫a�ӵ�Դ��______���������������������������ɼ״��ĵ缫��Ӧʽ��______��

��4��CO2���ȶ�����������Ϊʵ��CO2�Ļ�ѧ���ã������о������������______������ţ���
a��ѡ��������ķ�Ӧ���CO2��Ӧ��õ�������������
b�����õ��ܡ����ܻ����ܻCO2����
c��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������Ҫ�������Ȼ��ƾ��壬������ֻ�л��������ơ�̼����淋��Ȼ��ơ���֪��NH4HCO3![]() NH3����H2O��CO2����ijѧ����������·�����
NH3����H2O��CO2����ijѧ����������·�����

![]()
![]()
��ش��������⣺
(1)����ټ��ȵ�Ŀ����_____��
(2)д��������з��������ӷ���ʽ_____��
(3)����ڣ��ж�SO42-�ѳ����ķ�����_______________________________________��
(4)����۵�Ŀ����_____������1�õ��IJ���������_____��
(5)����2��������_____��Ӧ��_____(����������)�н��С�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com