
【题目】下列反应属于取代反应的是( )
A.甲烷燃烧生成二氧化碳和水
B.乙醇与氧气反应生成乙醛
C.乙烯与溴反应生成1,2-二溴乙烷
D.甲烷与氯气反应生成一氯甲烷
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是将传统的燃料与空气直接接触反应的燃烧借助于载氧剂(如Fe2O3、FeO等)的作用分解为几个气固反应,燃料与空气无需接触,由载气剂将空气中的氧传递给燃料。回答下列问题:
(1)用Fe2O3作载氧剂的化学链燃烧部分热化学方科式及循环转化的原理如下:
I.C(s)+H2O(g)==CO(g)+H2(g) △H1
II.Fe2O3(s)+1/3CO(g)=2/3Fe3O4(s)+1/3CO2(g) △H2
III.Fe2O3(s)+1/3H2(g)=2/3Fe3O4(s)+1/3H2O(g) △H3
IV.Fe3O4(s)+1/4O2(s)=3/2Fe2O3 (s) △H4
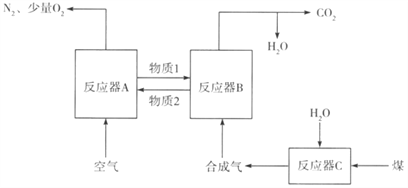
①在反应器B中进行的反应是_______(填反应前面的代号);“物质2”是______(填化学式)。
②反应C(s)+O2(g)=CO2(g)的△H=______(用△H1、△H2、△H3、△H4表示)。
(2)用FeO作载氧剂部分反应的lgKp[Kp是用平衡分压代替平衡浓度(平衡分压=总压×物质的量分数)]与温度的关系如下图所示:
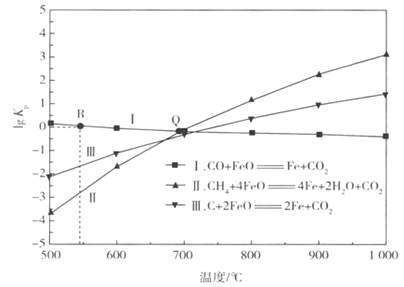
①图中涉及的反应中,属于吸热反应的是______(填反应前面的代号)。
②恒容密闭容器中进行反应:CH4(g) +4FeO(s)=4Fe(s) +2H2O(g)+CO2(g),不能说明该反应已达到化学平衡的标志是______( 填字母)。
a.v正(CH4)=v正(CO2)
b.气体的压强不再随时间变化
c.气体的密度不再随时间变化
d.单位时间内断裂C-H键与断裂H-O键数目相等
③若某恒容密闭容器中只发生反应I和II,平衡时对应上图中Q 处时,容器中气体分压p(X)间应满足的关系是__________。
④在某密闭容器中充入0.8 molCO和0.2 mol CO2 并加入足量的FeO,只发生反应I,在R点(lgKp=0),则CO的平衡转化率为________。
(3)若用CaSO4作载氧剂进行化学链燃烧时,CaSO4与CO发生反应生成CaS,则反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是
A. 2Na + 2H2O =2NaOH + H2↑ B. 2Na + O2![]() Na2O2
Na2O2
C. 2Na2O2 + 2CO2=2Na2CO3+O2 D. NaHCO3+HCl=NaCl+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:

已知:“沉锰”反应为:Mn2+ + 2HCO![]() == MnCO3↓+ H2O + CO2↑
== MnCO3↓+ H2O + CO2↑
(1)“酸浸”时发生的主要反应为:2Fe2+ + MnO2+ 4H+ == 2Fe3+ + Mn2+ + 2H2O。除此以外,还发生的反应离子方程式为________。(任写一个)
(2)“沉锰”工序中,实验测得MnCO3的产率与溶液pH、反应时间t的关系如图所示。反应要控制pH在7左右的理由是_________。(答两点)

(3)“过滤Ⅱ”所得滤液中溶质的主要成分是_________。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.800g软锰矿样品,加入4.020 g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,过量的Na2C2O4用0.2000 mol/L高锰酸钾溶液进行滴定,当滴入30.00mL溶液时恰好完全反应。已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO2 + C2O![]() + 4H+
+ 4H+ ![]() Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O
Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O![]() + H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
+ H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应涉及H2O、Cr2O72―、NO2―、H+、NO3―、Cr3+六种微粒,已知反应过程中NO2-浓度变化如图所示,下列说法不正确的是
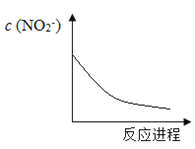
A. Cr2O72-中Cr化合价是+6价
B. 反应的氧化产物是NO3-
C. 消耗1mol氧化剂,转移电子6mol
D. 随着反应的进行,溶液中的H+ 浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
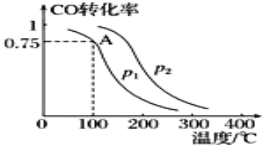
(1)p1___p2(填“>”、“<”或“=”),理由是___.
(2)该甲醇合成反应在A点的平衡常数K=___(用a和V表示).
(3)该反应达到平衡时,反应物转化率的关系是CO___H2.(填“>”、“<”或“=”)
(4)下列措施中能够同时满足增大反应速率和提高CO转化率的是___(填字母).
A. 使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OH从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com