
����Ŀ���������д����ĵ⣬ÿ1000g�����к���5g���ҡ�ʵ�����У��Ӻ�������ȡ��IJ�����������ͼ��

(1)�۵IJ���������________________���ݵIJ���������__________________��
(2)�Լ�b���������Ȼ�̼����������_________________________(������)��
(3)���ڢݵIJ������裬����˵����ȷ����_____________________(����ĸ)��
A. ��Һ��ʱ����Ҫ��ת��Һ©��
B. �����Һ�����Һ©������������̨�ϣ�������Һ
C. ��Һʱ�����²�Һ�嶼Ҫ�ӷ�Һ©���¿������ձ��ڱ����벻ͬ���ձ�
D. ��Һʱ����Ҫ������Һ©���Ϸ��IJ�������ʹ��Һ©���ܷ�
(4)�Լ�a��ѡ��ϡ�����ữ�Ĺ���������Һ����ȫ����ܷ�Ӧ�����ӷ���ʽ��___I�D +____H2O2+______==____I2+______��(ϵ��Ϊ��1��ʱ��Ҫд��1��)
(5)ij��ȤС�����ʵ�鷽�����Ӻ�I2��CCl4��Һ�з���I2��CCl4����֪��
�۵� | �е� | |
I2 | 114�� | 184�� |
CCl4 | -23�� | 77�� |
��С��ͬѧ�������ϣ�����������ķ�������װ������ͼװ�ã�����B��������_____��ͼ����һ�����Դ���Ӧ����Ϊ_______________________________________��
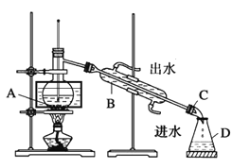
�ڸ�С��ͬѧ����װ�ô������ʵ�顣��80��ˮԡ����Ƭ�̣��۲쵽��ƿ�г�����ɫ��������ƿ��Ҳ��ʼ�ռ���dz�Ϻ�ɫ��Һ��������ƿ�в���������I2��ͨ��ʵ��ó����ۣ���ѹ�µ�����__________________________(�����ʺ����������ʺ���)����I2��CCl4��
���𰸡����� ��ȡ��Һ �������� A 2 1 2H+ 1 2H2O ������ �¶ȼƵ�ˮ������������ƿ��֧�ܿڴ� ���ʺ�
��������
������Ҫ���麣ˮ����ȡ�ⵥ�ʵ�ʵ����������ز�����
��1��������Ϊ��Һ���������������ΪҺҺ�����ܷ��������
��2�����ݳ�����ȡʵ������ȡ����ѡ��ԭ�������
��3�����ݷ�Һ�ľ��������ɣ�
��4������������ԭ��Ӧ���ϼ���������Լ�ԭ���غ㡢����غ���ƽ��
��5���ٸ���ʵ���ҳ�������������д����������ʵ�����¶ȼƵ�ˮ����λ����д��
�ڵⵥ��������������80��ʱ������CCl4һ�������ƿ�У��ɴ������жϡ�
��1��������Ϊ��Һ�����ܷ���������ʲ�������Ϊ���ˣ�������ΪҺҺ�����ܷ���������ʲ�������Ϊ��Һ��
��2���Լ�bΪ��ȡ������ʵ���л���ѡ�ñ������ͣ�
��3��������Ϊ��Һ��A.��Һ��ʱ����Ҫ��ת��Һ©�����Ա�֤��ȡ����������ȫ�Ӵ��������ȡ�ʣ���ȷ��B.�����Һ�����Һ©������������̨�ϣ�����������Һ��ȫ�ֲ�ʱ���ٽ��з�Һ������C.��Һʱ���ϲ�Һ����Ͽڵ������²�Һ��ӷ�Һ©���¿������������Լ�����Ⱦ������D.��Һʱ�����²�Һ������У��轫©���ϿڵIJ�������ʹ���ϵİ��ۻ�С��©�����ϵ�С�ף�ʹ©�����������ͨ���Ա�֤�²�Һ����˳��������������
��4���÷�Ӧ��H2O2��������������Oȫ����-1�۽���Ϊ-2�ۣ�I-��-1������Ϊ0�ۣ��÷�Ӧ�������Ի����½��У�����������ԭ��Ӧ���ϼ�������ȿ�֪���÷�Ӧ�����ӷ���ʽΪ��2I- + H2O2 + 2H+ ===I2 + 2H2O��
��5��������BΪ�����ܣ�����ʵ���У���ԭ���Ǹ���Һ��ķе������з��룬����ͨ���¶ȼƲ������Һ�������¶ȣ����¶ȼƵ�ˮ����Ӧ��֧�ܿ���ƽ�У�
���������Ϣ��֪��CCl4��80��ʱΪ��̬����I2��������������CCl4����һ�������ƿ�����ܴﵽ����I2��CCl4��ʵ��Ŀ�ġ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ-ѡ��5:�л���ѧ������������̹��һ�����Ʒζ�����Ѫѹҩ��,�ɷ��㻯����A�ϳ����м���G��һ�ֺϳ�·������:
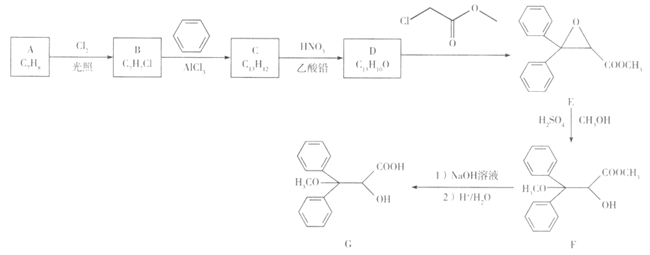
��֪:C�ĺ˴Ź�������ֻ��4 ��壬Dֻ��3��塣
�ش���������:
(1)A�Ļ�ѧ������_______��G�к��������ŵ�������______��
(2)C�Ľṹ��ʽ��______��D�Ľṹ��ʽ��______ ��
(3)B��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________��
(4)�������������ķ��㻯����X��E��ͬ���칹�壬X������������ˮ��ֻ����һ���л����X��____�֣����к˴Ź���������3���,�����֮��Ϊ3:2:2�Ľṹ��ʽΪ______ ��
(5)д���ü���ͱ�Ϊԭ���Ʊ�������2��4��6-������������ĺϳ�·��: ______(�����Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ���ܹ�����������ǣ�������
A.Fe3+ �� NH4+ �� NO3�� �� OH��
B.NH4+ �� OH�� �� Cl�� �� Al3+
C.Fe2+ �� H+ �� NO3�� �� Cl��
D.SO42�� �� OH�� �� Cl�� �� Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2��������Ƶķ����������й���SO2����������ȷ����
A.��ɫ��ζ����
B.��������������Һ��Ӧ
C.��ʹƷ����Һ��ɫ
D.һ�������£�����������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��H2���Ժϳɼ״�,��Ӧԭ��ΪCO(g)+2H2(g)�TCH3OH(g).һ��������,���ݻ�ΪV L���ܱ������г���a mol CO��2a mol H2�ϳɼ״���ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
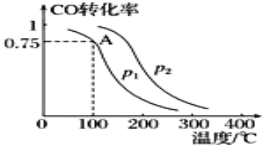
��1��p1___p2(�>������<����=��)��������___.
��2���ü״��ϳɷ�Ӧ��A���ƽ�ⳣ��K=___(��a��V��ʾ).
��3���÷�Ӧ�ﵽƽ��ʱ,��Ӧ��ת���ʵĹ�ϵ��CO___H2.(�>������<����=��)
��4�����д�ʩ���ܹ�ͬʱ��������Ӧ���ʺ����COת���ʵ���___(����ĸ).
A. ʹ�ø�Ч���� B.���ͷ�Ӧ�¶�
C. ������ϵѹǿ D.���Ͻ�CH3OH�ӷ�Ӧ������з������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̼�ܵ��о��ɹ������˿Ƽ��Ľ��������õ绡���ϳɵ�̼���ܳ����д��������ʡ���̼������������̼���������������������ᴿ���䷴ӦʽΪ��3C+2K2Cr2O7 +8H2SO4===3CO2��+2K2SO4
+2Cr2(SO4)3 +8H2O��
��1������˫���ŷ��������ת�Ʒ������Ŀ________________________________��
��2��������Ӧ����������______���ѧʽ������������Ԫ����________����Ԫ�ط��ţ���
��3��H2SO4 ��������Ӧ�б��ֳ�����������____________������ţ���
A�������� B�������Ժ����� C������ D����ԭ�Ժ�����
��4������Ӧ�е���ת����0.8 mol��������������ڱ�״���µ����Ϊ_________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������������������������ʻ���������������������̱���
���������ڹ����β��ϵ���________(����ĸ����ͬ)��
a. ��ɡ�����������b. ��ͭ��������������c. ����
��Ϊ��ֹ����������ʴ�����оٴ벻��������________��
a. �����п�� b. ʹ�ò���֡� c. ���渽��ͭƬ
�����첣����ˮ�����Ҫԭ���У����õ���ԭ����________��
a. ʯ��ʯ b. ���� c. ���
��2��ijƷ��ʳƷ���ϱ�ǩ��һ��������ͼ��

�������еĴ���������̬����Դ�ڻƶ��еĵ����ʷ���________��Ӧ�õ���
��С����е���ҪӪ��������________��
�������У�������ɫ������______��������ζ������__________�����ڷ���������______��
��3����ɫ��չ����̼��չ��ѭ����չ����̬��������Ļ���;����
�ٴ�Դˮ����������ˮ�������������������̿�����Լ�ͨ���������ȣ�����ͨ����������������__________________________��
��Ŀǰ�ҹ��������������ϵ������PM2.5��PM10��SO2��NO2��O3��CO����ָ�ꡣ����ָ���ж������������γ��дٽ����á������������ܽ�һ���Ӿ�����ۿ��������__________���������������ΪSO2��________��ú�м���������ʯ��ʯ���Լ���ȼú������SO2��������Ӧ�Ļ�ѧ����ʽΪ______________________________________________��
���ö�����̼����������Ʒ�������ڶ�����̼�Ĵ������ա�CO2��H2�ڴ��������¡���ѹ�����¿��Ժϳ��Ҵ����÷�Ӧ�Ļ�ѧ����ʽΪ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�NaClO��Һ��KI��Һ�ķ�Ӧ��ʵ���¼���£�
ʵ���� | ʵ����� | ʵ������ |
�� |
| ������Һ��Ϊdz��ɫ ������Һ���� |
�� |
| ������Һ������ɫ ������Һ����������Һ��pH=10 |
������������Ļ�������Ҫ��I��IO3����ʽ����������������IO3��������Cl����������I��ClO��pH<4�����ȵ������¼����ȶ���
��1��0.5 mol��L1 NaClO��Һ��pH��11�������ӷ���ʽ��ʾ��ԭ����______��
��2��ʵ��������Һ��Ϊdz��ɫ�����ӷ���ʽ��______��
��3���Ա�ʵ�����͢��о�ʵ������Ӧ������Һ����������ԭ��
�� �������a��I2�ڼ�����Һ�в��ܴ��ڡ����ʵ����֤ʵ�˼���a������ʵ���IJ�����������______��
�� ��һ���������b��NaClO�ɽ�I2����ΪIO3������ʵ��֤ʵ�˼���b������װ������ͼ�����м���Һ��______��ʵ��������______��

��4������ʵ���������Һ�е�IO3��
ȡʵ����������Һ���μ�ϡ�������������������̾�δ������ɫ��һ��ʱ����л���ɫ�̼�����ζ����������������Һ��pH��2���ټ���KI��Һ����Һ������˵��ʵ����������Һ�д���IO3��
�� �����Ļ���ɫ������______��
�� ��ͬѧ��Ϊ��ʵ�鲻��˵��ʵ���������Һ�д���IO3��������______����֤��ʵ����������Һ�д���IO3���Ľ���ʵ�鷽����______��
�� ʵ�����з�Ӧ�����ӷ���ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��д���������ʼ䷴Ӧ�����ӷ�Ӧ����ʽ��
��1��NaHSO4��Һ��NaHCO3��Һ��ϣ�____________________��
��2��Mg(OH)2������������������Һ��_____________________��
��3����![]() ��Һ�м�������NaOH��Һ����Ӧ�����ӷ���ʽ��_____________��
��Һ�м�������NaOH��Һ����Ӧ�����ӷ���ʽ��_____________��
��4����![]() ��Һ�м�������NaOH��Һ����Ӧ�����ӷ���ʽ��____________��
��Һ�м�������NaOH��Һ����Ӧ�����ӷ���ʽ��____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com