
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
【答案】 ClO + H2O![]() OH + HClO ClO + 2I + H2O == I2 + Cl + 2OH 向pH=10的NaOH溶液中加入少量滴有淀粉溶液的碘水,振荡,蓝色褪去 碘水 右侧碘水棕黄色变浅,电流表的指针偏转 Cl2 溶液中的Cl2或HClO也可将I氧化为I2,使溶液变蓝 加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液 3ClO + I == 3Cl + IO3
OH + HClO ClO + 2I + H2O == I2 + Cl + 2OH 向pH=10的NaOH溶液中加入少量滴有淀粉溶液的碘水,振荡,蓝色褪去 碘水 右侧碘水棕黄色变浅,电流表的指针偏转 Cl2 溶液中的Cl2或HClO也可将I氧化为I2,使溶液变蓝 加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液 3ClO + I == 3Cl + IO3
【解析】(1)NaClO为强碱弱酸盐,水解显碱性,离子方程式:ClO + H2O![]() OH + HClO;正确答案: ClO + H2O
OH + HClO;正确答案: ClO + H2O![]() OH + HClO。
OH + HClO。
(2)次氯酸钠具有强氧化性,能够把碘离子氧化为碘单质,碘水溶液显黄色,离子方程式是ClO + 2I + H2O == I2 + Cl + 2OH;正确答案:ClO + 2I + H2O == I2 + Cl + 2OH。
(3)①碘与淀粉溶液相遇变为蓝色,向变蓝的溶液中加入pH=10的NaOH溶液,I2与碱性溶液发生反应,碘反应完全后,蓝色溶液褪去;正确答案:向pH=10的NaOH溶液中加入少量滴有淀粉溶液的碘水,振荡,蓝色褪去。
② 根据NaClO可将I2氧化为IO3,以及左侧烧杯中盛放次氯酸钠溶液可知,甲溶液为碘水,此装置为原电池,右侧为原电池的负极,发生氧化反应,I2氧化为IO3,所以碘水棕黄色变浅,电流表的指针偏转 ;正确答案:碘水;右侧碘水棕黄色变浅,电流表的指针偏转。
(4)①氯气为黄绿色气体,所以产生的黄绿色气体是氯气;正确答案: Cl2 。
②碘离子具有还原性,溶解在水中的氯气或氯气与水反应产生的次氯酸都能将I氧化为I2,使溶液变蓝;若证明实验Ⅱ所得溶液中存在IO3,就应该避免氯气或次氯酸的干扰,因此可以采用加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液,来验证结论;正确答案:溶液中的Cl2或HClO也可将I氧化为I2,使溶液变蓝; 加热pH=2的溶液至无色,使黄绿色气体(或Cl2)充分逸出,使HClO完全分解,冷却后再加入KI溶液 。
③次氯酸根离子具有氧化性,能够把碘离子氧化为碘单质,实验Ⅱ中反应的离子方程式是3ClO + I == 3Cl + IO3;正确答案:3ClO + I == 3Cl + IO3。


科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 稀醋酸与碳酸钠反应:CO![]() +2H+ == CO2↑+H2O
+2H+ == CO2↑+H2O
B. FeCl2溶液中通入Cl2:Fe2+ + Cl2 == Fe3+ + 2Cl―
C. 铜片与稀HNO3反应:Cu+2H+ == Cu2+ +H2↑
D. 用NaOH溶液吸收多余Cl2:Cl2+2OH-== Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。

(1)③的操作名称是________________,⑤的操作名称是__________________。
(2)试剂b可以是四氯化碳,还可以是_________________________(填名称)。
(3)关于⑤的操作步骤,下列说法正确的是_____________________(填字母)。
A. 振荡液体时,需要倒转分液漏斗
B. 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C. 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D. 分液时,需要塞进分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:___I― +____H2O2+______==____I2+______。(系数为“1”时,要写“1”)
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
熔点 | 沸点 | |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,图中有一个明显错误,应改正为_______________________________________。
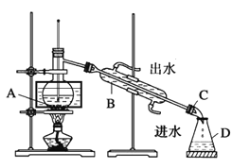
②该小组同学改正装置错误后,进行实验。用80℃水浴加热片刻,观察到烧瓶中出现紫色蒸气,锥形瓶中也开始收集到浅紫红色溶液,最终烧瓶中残留少量的I2。通过实验得出结论,常压下的蒸馏__________________________(填“适合”或“不适合”)分离I2和CCl4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是______。
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
获取乙二醇的反应历程可分为如下2步:
Ⅰ.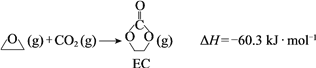
Ⅱ.EC加氢生成乙二醇与甲醇
![]()
① 步骤Ⅱ的热化学方程式是______。
② 研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/ ℃ | EC转化率/ % | 产率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是______。温度升高到220 ℃时,乙二醇的产率反而降低,原因是______。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a接电源的______极(填“正”或“负”),生成甲醇的电极反应式是______。

(4)CO2较稳定、能量低。为实现CO2的化学利用,下列研究方向合理的是______(填序号)。
a.选择高能量的反应物和CO2反应获得低能量的生成物
b.利用电能、光能或热能活化CO2分子
c.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;Ⅳ、Ⅴ、Ⅵ是气体收集装置,根据要求回答下列问题:
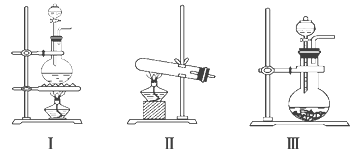
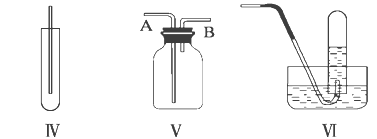
(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置_____,用方程式表示制取氯气的反应原理是______。
(2)若用KMnO4与浓盐酸反应制取氯气,试完成并配平下列离子方程式:
____MnO42-+____Cl-+____H+===____Mn2++____Cl2↑+____________。
(3)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是____________。
(4)若选用Ⅴ为氯气收集装置,则氯气应从__________口通入。用化学方法检验氯气收集满了的方法是_______。
(5)科学家经研究发现NaClO2可用于制取自来水消毒剂ClO2。在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2。还原产物为_____,当消耗标准状况下1.12L Cl2 时,制得ClO2_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.长期饮用纯净水有益于人体健康
B.长期服用阿司匹林可以预防某些疾病,没有副作用
C.纯天然物质都是绿色无毒的物质
D.长期食用花生油比猪油更有利于健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关CuSO4溶液的叙述不正确的是( )
A. 通入CO2气体产生蓝色沉淀
B. 通入H2S气体产生黑色沉淀
C. 与适量浓氨水反应:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
D. 电解精炼铜时用CuSO4和H2SO4的混合液作电解液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com