
【题目】下列离子方程式正确的是
A. 稀醋酸与碳酸钠反应:CO![]() +2H+ == CO2↑+H2O
+2H+ == CO2↑+H2O
B. FeCl2溶液中通入Cl2:Fe2+ + Cl2 == Fe3+ + 2Cl―
C. 铜片与稀HNO3反应:Cu+2H+ == Cu2+ +H2↑
D. 用NaOH溶液吸收多余Cl2:Cl2+2OH-== Cl-+ClO-+H2O
 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
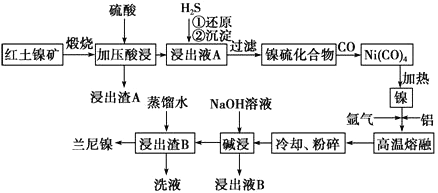
(1)浸出渣A的主要成分是_______________(填化学式)。
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有大量Ni2+,写出有关镍元素的加压酸浸的化学反应方程式_______________________________。
(3)向浸出液A中通入H2S气体,①还原过程中所涉及主要反应的离子方程式是__________________________________。
(4)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为________。 (5)“碱浸”的目的是使镍产生多孔结构,从而增强对氢气的强吸附性,此过程中发生反应的离子方程式为__________________________。
(6)常温时,向浓度均为1.0mol·L-1的FeSO4、NiSO4的混合溶液中滴加Na2S 固体,当Ni2+恰好沉淀完全时,所得溶液中c(Fe2+)=______________。
(已知:①25℃,Ksp(NiS)=2.0×10-21、Ksp(FeS)=6.0×10-18
②溶液中的离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。)
(7)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→___________________________________________________________。 (箭头上注明外加反应物的化学式和反应条件)。(示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修5:有机化学基础】安立生坦是一种治疗肺动脉高血压药物,由芳香化合物A合成其中间体G的一种合成路线如下:
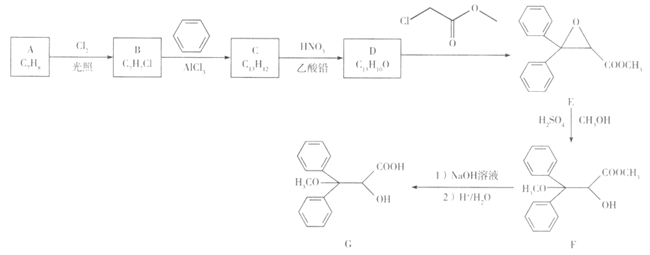
已知:C的核磁共振氢谱只有4 组峰,D只有3组峰。
回答下列问题:
(1)A的化学名称是_______,G中含氧官能团的名称是______。
(2)C的结构简式是______,D的结构简式是______ 。
(3)B与NaOH溶液反应的化学方程式是____________。
(4)含有两个苯环的芳香化合物X是E的同分异构体,X在酸性条件下水解只生成一种有机物,则X有____种,其中核磁共振氢谱有3组峰,峰面积之比为3:2:2的结构简式为______ 。
(5)写出用甲烷和苯为原料制备化合物2,4,6-三硝基苯甲酸的合成路线: ______(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2018·四川省成都市第三次诊断性检测)已知H2A为二元弱酸,室温下向100.0mL0.1mol/LH2A溶液中加入不同质量的NaOH固体,pH变化如下表(不考虑溶液体积变化)。下列分析正确是
m(NaOH)/g | 0 | 0.4 | 0.8 | 1.2 |
pH | 3.8 | 8.3 | 12.0 | 13.2 |
A. H2A第一步电离K1的数量级为10-8
B. 上述过程中水的电离程度一直增大
C. m(NaOH)=0.6g时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 若溶液中加NaOH至![]() 时,c(OH-)>100c(H+)
时,c(OH-)>100c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定条件下aA+bB![]() cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向逆反应方向移动,则a、b、c、d关系是__________________。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是__________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是__________________反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡正向移动,则a、b、c、d关系是__________________。
Ⅱ.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
(1)在一定温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol·L-1。该反应的平衡常数K=__________________。
(2)若在一体积可变的容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________________(填“正”、“逆”)反应方向移动。
(3)若在温度和容积相同的三个密闭容器中,按不同方式投人反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度(mol/L) | 能量变化(Q1、Q2、Q3均大于0) |
1 | 2molCO和4molH2 | a1% | c1 | 放出Q1kJ热量 |
2 | 2molCH3OH | a2% | c2 | 吸收Q2kJ热量 |
3 | 4molCO和8molH2 | a3% | c3 | 放出Q3kJ热量 |
则下列关系正确的是 __________________。
A. c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1 +a2 =1 E.该反应若生成2mol CH3OH,则放出(Q1+Q2)kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能够大量共存的是( )
A.Fe3+ , NH4+ , NO3﹣ , OH﹣
B.NH4+ , OH﹣ , Cl﹣ , Al3+
C.Fe2+ , H+ , NO3﹣ , Cl﹣
D.SO42﹣ , OH﹣ , Cl﹣ , Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2可用作红酒的防腐剂。下列关于SO2的叙述不正确的是
A.无色无味气体
B.能与氢氧化钠溶液反应
C.能使品红溶液褪色
D.一定条件下,能与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com