
【题目】下列物质属于共价化合物的是
A.NaClB.CO2C.CaCl2D.NH4Cl
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
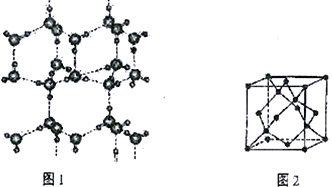
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25 ℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是
A. 1×10-2 mol·L-1 B. 1×10-8 mol·L-1
C. 1×10-12 mol·L-1 D. 1×10-4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。
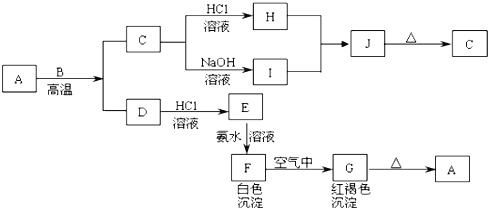
请回答下列问题
(1)写出下列物质的化学式A______,E_______,J________,G_______。
(2)F在空气中转化为G的化学方程式:______。
(3)C转化为I的离子方程式:______。
(4)H和I生成J的离子方程式:______。
(5)D在高温下和水蒸气反应的化学方程式:______。
(6)如何检验E中大量存在的阳离子?___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 稀醋酸与碳酸钠反应:CO![]() +2H+ == CO2↑+H2O
+2H+ == CO2↑+H2O
B. FeCl2溶液中通入Cl2:Fe2+ + Cl2 == Fe3+ + 2Cl―
C. 铜片与稀HNO3反应:Cu+2H+ == Cu2+ +H2↑
D. 用NaOH溶液吸收多余Cl2:Cl2+2OH-== Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据分子中所含官能团可预测有机化合物的性质。
① 下列化合物中能发生消去反应的是_________(填字母)。
a.CH3OH b.CH3CH2Cl c.HC≡CH
② 下列化合物中,常温下能被空气氧化的是_________(填字母)。
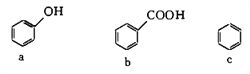
③ 下列化合物中,能发生水解反应的是_________(填字母)。
a.H2C=CH2 b.CH3COOCH2CH3 c.CH3CH2OH
(2)甲苯(![]() )是一种重要的有机化工原料。
)是一种重要的有机化工原料。
① 甲苯分子中一定共平面的碳原子有________个。
② 甲苯苯环上的一溴代物有______种,请写出其中一种的名称:_________。
③ 除去甲苯中混有的少量苯酚,可选用的试剂是_________,写出该反应的化学方程式:__________。
(3)化合物C是一种医药中间体,可通过下列方法合成:
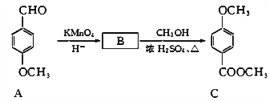
① A中含氧官能团的名称为_________和_________。
② B的结构简式为_________。
③ B→C的反应类型为__________。
④ C的同分异构体D能发生银镜反应,能与FeCl3溶液发生显色反应。且1 mol D最多能与2 mol NaOH反应。D分子中有4种不同化学环境的氢,请写出D的一种结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从宏观现象探究微观本质是重要的化学学科素养。
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
(资料1)亚硫酸(H2SO3)易分解生成SO2和H2O。
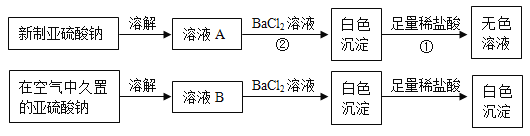
(1)写出上述实验中①、②的离子方程式_________________,_________________。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有_____________(填化学式),亚硫酸钠在空气中变质体现了亚硫酸钠的_________________性。
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
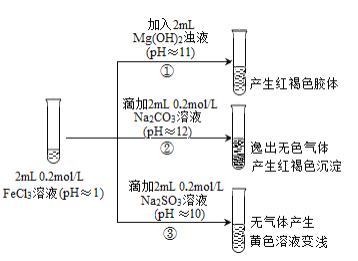
(资料2)含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是_____________________________。
(2)②中逸出的无色气体是_______________________________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_______________。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_________。
(4)由上述实验可知,下列说法正确的是________(填字母)。
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;Ⅳ、Ⅴ、Ⅵ是气体收集装置,根据要求回答下列问题:
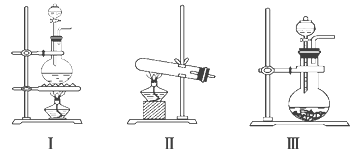
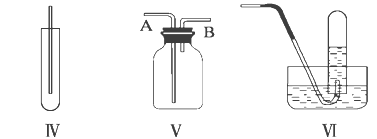
(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置_____,用方程式表示制取氯气的反应原理是______。
(2)若用KMnO4与浓盐酸反应制取氯气,试完成并配平下列离子方程式:
____MnO42-+____Cl-+____H+===____Mn2++____Cl2↑+____________。
(3)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是____________。
(4)若选用Ⅴ为氯气收集装置,则氯气应从__________口通入。用化学方法检验氯气收集满了的方法是_______。
(5)科学家经研究发现NaClO2可用于制取自来水消毒剂ClO2。在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2。还原产物为_____,当消耗标准状况下1.12L Cl2 时,制得ClO2_____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com