
【题目】从宏观现象探究微观本质是重要的化学学科素养。
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
(资料1)亚硫酸(H2SO3)易分解生成SO2和H2O。
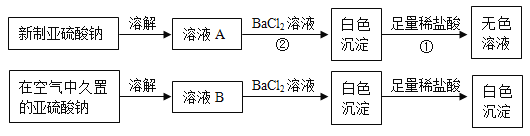
(1)写出上述实验中①、②的离子方程式_________________,_________________。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有_____________(填化学式),亚硫酸钠在空气中变质体现了亚硫酸钠的_________________性。
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
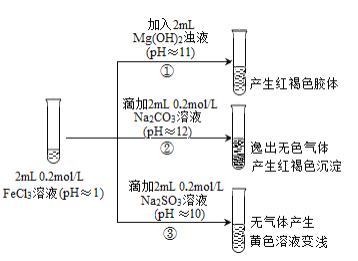
(资料2)含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是_____________________________。
(2)②中逸出的无色气体是_______________________________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_______________。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_________。
(4)由上述实验可知,下列说法正确的是________(填字母)。
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
【答案】BaSO3+2H+==Ba2++SO2![]() +H2O SO32-+Ba2+==BaSO3 Na2SO4 还原性 2Fe3++3Mg(OH)2==2Fe(OH)3+3Mg2+ CO2 2Fe3+ +SO32-+H2O ==2Fe2++SO42-+2H+ 取③中反应后的溶液,加入K3Fe(CN)6溶液,生成蓝色沉淀,说明生成了Fe2+ bcd
+H2O SO32-+Ba2+==BaSO3 Na2SO4 还原性 2Fe3++3Mg(OH)2==2Fe(OH)3+3Mg2+ CO2 2Fe3+ +SO32-+H2O ==2Fe2++SO42-+2H+ 取③中反应后的溶液,加入K3Fe(CN)6溶液,生成蓝色沉淀,说明生成了Fe2+ bcd
【解析】
本题主要考查探究物质的性质化学实验设计。
I.亚硫酸钠在空气中久置,因亚硫酸钠具有还原性,可能与空气中的O2发生氧化还原反应生成硫酸钠。
(1)溶液A中含有SO32-,与Ba2+反应生成BaSO3沉淀;BaSO3与稀盐酸反应生成BaCl2和SO2和H2O;
(2)溶液B中加入BaCl2溶液后生成的白色沉淀不溶于稀盐酸,说明该沉淀为BaSO4;SO32-生成SO42-过程是被氧化;
II.(1)氯化铁溶液和Mg(OH)2浊液反应生成红褐色的Fe(OH)3沉淀;
(2)由FeCl3溶液呈酸性分析,pH=1的FeCl3溶液与pH=12的Na2CO3溶液等物质的量混合后产生的气体成分;
(3)SO32-被Fe3+氧化为SO42-,Fe3+被还原为Fe2+,由此写出离子方程式;因SO32-可能被空气氧化,若要证实SO32-与Fe3+发生氧化还原反应,根据题干信息可选用K3Fe(CN)6溶液检验溶液中是否有Fe2+;
(4)a.实验①中加入的碱为Mg(OH)2;
b.FeCl3溶液呈酸性,Na2CO3溶液、Na2SO3溶液呈碱性,NaCl溶液呈中性;
c.实验②和实验③为两种盐相互反应,生成物不是两种新盐;
d.实验③中,盐与盐反应不属于复分解反应。
I.亚硫酸钠在空气中久置,因亚硫酸钠具有还原性,可能与空气中的O2发生氧化还原反应生成硫酸钠。
(1)实验①中反应为BaSO3与稀盐酸反应生成BaCl2和SO2和H2O,其离子方程式为:BaSO3+2H+==Ba2++SO2![]() +H2O;溶液A中含有SO32-,与Ba2+反应生成BaSO3沉淀,其离子方程式为SO32-+Ba2+==BaSO3;
+H2O;溶液A中含有SO32-,与Ba2+反应生成BaSO3沉淀,其离子方程式为SO32-+Ba2+==BaSO3;
(2)溶液B中加入BaCl2溶液后生成的白色沉淀不溶于稀盐酸,说明该沉淀为BaSO4,说明在空气中久置的亚硫酸钠固体中混有Na2SO4;SO32-生成SO42-过程是被氧化,故体现了亚硫酸钠的还原性;
II.(1)实验①中反应为氯化铁溶液和Mg(OH)2浊液反应生成红褐色的Fe(OH)3沉淀,其离子方程式为:2Fe3++3Mg(OH)2==2Fe(OH)3+3Mg2+;
(2)实验②为pH=1的FeCl3溶液与pH=12的Na2CO3溶液等物质的量混合后,生成的气体为CO2;
(3)由实验现象可知,Fe3+被还原为Fe2+,化合价降低,故SO32-被Fe3+氧化为SO42-,其离子反应方程式为:2Fe3+ +SO32-+H2O ==2Fe2++SO42-+2H+;因SO32-可能被空气氧化,若要证实SO32-与Fe3+发生氧化还原反应,可通过验证是否有Fe2+生成,根据题干信息可知,可选用K3Fe(CN)6溶液进行检验,故实验方案为:取③中反应后的溶液,加入K3Fe(CN)6溶液,生成蓝色沉淀,说明生成了Fe2+;
(4)a.实验①中加入的碱为Mg(OH)2,属于难溶性碱,错误;
b.由题干信息可知,FeCl3溶液呈酸性,Na2CO3溶液、NasSO3溶液呈碱性,NaCl溶液呈中性,正确;
c.实验②和实验③为两种盐相互反应,生成物不是两种新盐,正确;
d.实验③中,盐与盐反应不属于复分解反应,正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A.分液漏斗使用前需要先检查是否漏液
B.试验中剩余的钠不能再放回原试剂瓶
C.做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D.蒸馏烧瓶加热时需要垫石棉网
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铜电极的叙述中不正确的是
A.用电解法精炼粗铜时,粗铜作阳极
B.在原电池中,铜电极只能作正极
C.在镀件上镀铜时,金属铜作阳极
D.锌铜原电池(稀硫酸为电解质溶液),铜极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2可用作红酒的防腐剂。下列关于SO2的叙述不正确的是
A.无色无味气体
B.能与氢氧化钠溶液反应
C.能使品红溶液褪色
D.一定条件下,能与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。
①三种溶液pH由大到小的顺序为:__________________填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)____c(CO32-) (填“>”、“<”或“=”)。
(2)已知25℃时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅拌后,相同温度下银离子浓度由大到小的顺序是________ 。 (填写序号);b中氯离子的浓度为_______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4
+2Cr2(SO4)3 +8H2O。
(1)请用双线桥法标出电子转移方向和数目________________________________。
(2)上述反应中氧化剂是______(填化学式),被氧化的元素是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,当反应aA(g) ![]() bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com