
【题目】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
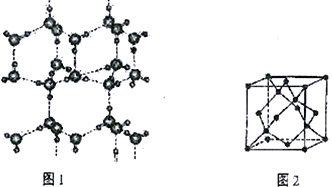
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)
【答案】 体心立方堆积 8 H-C![]() N C22- 平面三角形 非极性 sp3杂化 1s22s22p63s23p63d6 或[Ar]3d6 C<O<N 16 ρ=
N C22- 平面三角形 非极性 sp3杂化 1s22s22p63s23p63d6 或[Ar]3d6 C<O<N 16 ρ=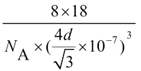
【解析】(1)金属铁的紧密堆积方式为体心立方堆积,体心Fe原子与顶点8个Fe原子相邻,其配位数为8。(2)HCN碳形成2个δ键,2个π键,HCN 分子的结构式为 H-C![]() N ,与CN-互为等电子体的阴离子是C22-。(3)K2CO3中阴离子中心原子碳形成3个δ键,孤电子对为0,空间构型为平面三角形,CO2为非极性分子,H2O中O原子有两个孤电子对,形成2个δ键,杂化轨道类型为 sp3杂化。(4)配合物K4Fe(CN)6的中心离子的电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 。(5)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,所以它们的第一电离能大小顺序是:N>O>C。(6)如图2,一个晶胞中水分子数为8×1/8+6×1/2+4=8个,晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有半个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2 mol氢键,在一个晶胞中有8×2=16个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为 ρ=
N ,与CN-互为等电子体的阴离子是C22-。(3)K2CO3中阴离子中心原子碳形成3个δ键,孤电子对为0,空间构型为平面三角形,CO2为非极性分子,H2O中O原子有两个孤电子对,形成2个δ键,杂化轨道类型为 sp3杂化。(4)配合物K4Fe(CN)6的中心离子的电子排布式为1s22s22p63s23p63d6 或[Ar]3d6 。(5)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,所以它们的第一电离能大小顺序是:N>O>C。(6)如图2,一个晶胞中水分子数为8×1/8+6×1/2+4=8个,晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有半个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2 mol氢键,在一个晶胞中有8×2=16个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为 ρ=![]() =
=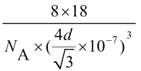


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图所示实验装置,回答下列问题。
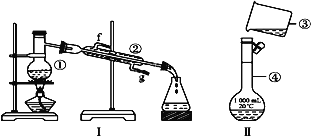
(1)写出下列仪器的名称:①______________,②_____________,④____________。
(2)仪器①~④中,使用时必须检查是否漏水的是____________(填序号)。
(3)若分离酒精和水的混合物,分离方法为___________,该方法适用于分离________不同的混合物,若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是_____________;②的进水口是____________(填“f”或“g”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应,会生成橙黄色的易爆物二氧化氯(ClO2)气体,该反应的化学方程式为2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O。
(1)该反应中还原产物与氧化产物的物质的量之比为_________________。
(2)若该反应中有490克KClO3参加反应,则被氧化的HCl的质量为______________。
(3)若该反应产生2.24L(标准状况)ClO2,则转移的电子数目为_____________。
(4)某地生产的食盐氯化钠中含有少量的剧毒物质氰化钠(NaCN),用ClO2可除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒气体。写出该反应的化学方程式: ______________________。
(5)用双线桥法表示下列氧化还原反应的电子转移情况:____________________
2KClO3+4HCl(浓) === 2KCl + 2ClO2↑+ Cl2↑+ 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
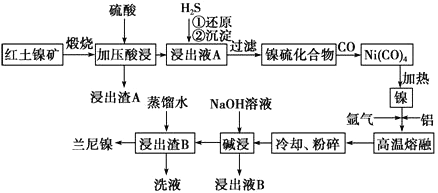
(1)浸出渣A的主要成分是_______________(填化学式)。
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有大量Ni2+,写出有关镍元素的加压酸浸的化学反应方程式_______________________________。
(3)向浸出液A中通入H2S气体,①还原过程中所涉及主要反应的离子方程式是__________________________________。
(4)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为________。 (5)“碱浸”的目的是使镍产生多孔结构,从而增强对氢气的强吸附性,此过程中发生反应的离子方程式为__________________________。
(6)常温时,向浓度均为1.0mol·L-1的FeSO4、NiSO4的混合溶液中滴加Na2S 固体,当Ni2+恰好沉淀完全时,所得溶液中c(Fe2+)=______________。
(已知:①25℃,Ksp(NiS)=2.0×10-21、Ksp(FeS)=6.0×10-18
②溶液中的离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。)
(7)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→___________________________________________________________。 (箭头上注明外加反应物的化学式和反应条件)。(示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】由羧酸A (C3H4O2) 经过如下合成路线获得药物中间体H。
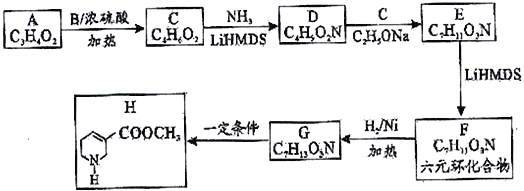
已知:Ⅰ.R1CH=CH1+RNH2 ![]() R1CH2CH2NHR(R可以是氢原子或烃基)
R1CH2CH2NHR(R可以是氢原子或烃基)
Ⅱ.R1COOR2+R3CH2COOR4![]()
![]() +R2OH
+R2OH
请回答:
(1)化合物A 的名称_________________,B的结构简式_______________。
(2)写出药物中间体H中两种官能团的名称_______________________。
(3)已知D的结构简式:H2N-CH2-CH2-COOCH3,D→E的反应类型________________,F→G的反应类型_________________。
(4)写出E→F的化学方程式______________________________________。
(5)写出化合物D符合下列条件的所有可能的同分异构体的结构简式_______(任写两种即可)
①分子中含六元环。
②红外光谱显示分子中含有碳氮单键。
③核磁共振氢谱显示分子中有3种化学环境不同的氢原子。
(6)设计由乙酸甲脂合成聚合物:![]() 的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl-、SO42-四种离子,已知前三种离子的个数比为3∶2∶1,则溶液中Al3+和SO42-的离子个数比为( )
A.1∶2B.1∶4C.3∶4D.3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作错误的是( )
A.分液漏斗使用前需要先检查是否漏液
B.试验中剩余的钠不能再放回原试剂瓶
C.做焰色反应时,铂丝应用盐酸洗净并灼烧至无色
D.蒸馏烧瓶加热时需要垫石棉网
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com