
【题目】下列气体的主要成分不是甲烷的是
A. 沼气 B. 天然气 C. 焦炉气 D. 坑道气
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某些物质的有关数据如下表,回答以下问题:
熔点(℃) | 沸点(℃) | 水溶性 | Ka1 | Ka2 | |||
乙醇 | -114.1 | 78.3 | 易溶 | 乙醇 | 2.6×10-16 | ||
乙醛 | -121 | 20.8 | 易溶 | H2SO3 | 1.23×10-2 | 5.6×10-8 | |
乙酸乙酯 | -83 | 77.0 | 难容 | H2CO3 | 4.2×10-7 | 5.6×10-11 |
实验一 乙醇在铜的催化下转化为乙醛
将一束质量为w的铜丝灼烧变黑后,迅速插入装有乙醇的试管a中。
(1)铜丝上可观察到的现象是______________,解释该现象的化学反应方程式为____________;
实验二 乙醛的提纯
上述实验获得的乙醛含有较多乙醇,可以通过以下操作提纯。

已知:CH3CHO+NaHSO3![]()
![]() (a-羟基乙磺酸钠)
(a-羟基乙磺酸钠)
(2)写出Na2CO3溶液参与反应的化学方程式:________________;
(3)某同学设计操作B的装置(夹持和加热装置已略去)如图所示。
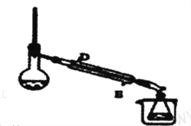
①冷凝管中的液体应从_____口进。(填“D”或“E”)
②下列有关操作与装置的分析,正确的是_____。(填字母)
a.烧杯中应装冰水 b.冷凝管应通温水 c.图示装置可用于除去乙酸乙酯中混有的乙醇
实验三 乙醛溶液浓度的测定
室温下利用反应Na2SO3+CH3CHO+H2O→CH3CH(OH)SO3Na↓+NaOH可以测定“实验一”中试管a内乙醛溶液浓度,操作如下:
取试管a中溶液4mL,加入1mL饱和Na2SO3溶液(过量),再加入5mL水,充分振荡后用pH计测定溶液pH;另取试管b,加入4mL乙醇做空白试验,实验结果如右表:
实验试管 | pH | ||
第一次 | 第二次 | 第三次 | |
A | 12.42 | 12.40 | 12.38 |
b | 10.43 | 10.43 | 10.40 |
(4)试管a中乙醛溶液的物质的量浓度为___mol/L。(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是利用无土栽培法培养蔬菜时,培养液中元素的配方,其中根细胞吸收最少的是
离子 | K+ | M g2+ | Ca2+ | NO3- | H2PO4- | SO42- | Zn2+ |
培养液浓度(mol/L) | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
A. H2PO4-B. SO42-C. Ca2+D. Zn 2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2 L的密闭容器中,将2 mol L气体和3 mol M气体混合,发生如下反应:2L(g)+3M(g)![]() xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
xQ(g)+3R(g),10s末,生成2.4 mol R,并测得Q的浓度为0.4 mol·L-1。计算:
(1)10 s末L的物质的量浓度为_____________。
(2)前10 s内用M表示的化学反应速率为_____________。
(3)化学方程式中x值为_____________。
(4)在恒温恒容条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
(5)在恒温恒压条件,往容器中加入1 mol氦气,反应速率________(增大、减小、不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
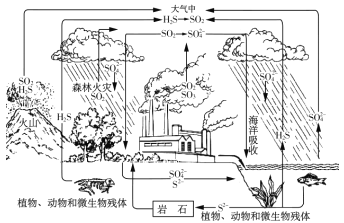
(1)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程 __________。
(2) 火山喷发产生 H2S 在大气当中发生如下反应:
①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。
H2S(g)与 O2(g)反应产生 SO2(g)和 H2O(g)的热化学方程式是__________。
(3) 降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。
①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是__________。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:
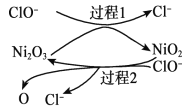
ii.过程 1 的离子方程式是__________。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是__________。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。
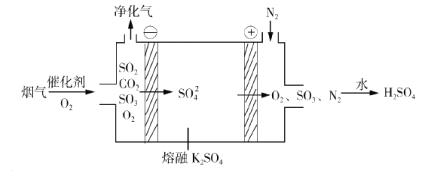
i.在阴极放电的物质是______。
ii.在阳极生成 SO3的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学设计实验,完成Cu和 Fe2(SO4)3溶液的反应,用 KSCN 溶液检验是否还存在 Fe3+。
实验 I:

已知: i. Cu2+![]() CuSCN↓(白色) + (SCN)2(黄色)
CuSCN↓(白色) + (SCN)2(黄色)
ii. (SCN)2的性质与卤素单质相似
iii. CuSCN溶于稀硝酸,发生反应 CuSCN+HNO3==CuSO4+N2+CO2+H2O(未配平)
(1) 依据现象i可预测该反应的离子方程式为__________________________。
(2) 该小组同学查阅资料认为现象ii中的白色沉淀可能为CuSCN,设计实验进行验证。
实验II: 取少量实验I中的白色沉淀于试管中_______________________,证明该白色沉淀为CuSCN。(补充所加试剂及实验现象)
(3)该小组同学继续探究白色沉淀的成因,进行如下实验,
实验III:
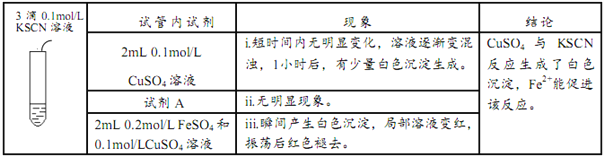
在实验III中:
①写出现象i中生成白色沉淀的离子方程式____________。
②试剂A为___________。
③根据现象iii结合化学用语及必要的文字解释Fe2+能加快沉淀生成的原因______。
(4)有的同学认为实验III不能充分证明其结论,并补充实验IV如下:
取2mL0.1 mol/L Fe2(SO4)3滴加3滴0.1mol/L KSCN溶液后,溶液变红,然后滴加2mL0.1mol/LCuSO4混合溶液于试管中, _____________________(现象)说明白色沉淀不是由Fe3+与SCN- 生成,且Fe3+不能加快CuSCN的生成。
(5)改变实验I铜的用量,设计实验V

该小组同学认为实验V中现象ii红色褪去与平衡移动有关,解释为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的图示及分析均正确的是
选项 | 实验目的 | 实验图示 | 实验分析 |
A | 实验室用酸性高锰酸钾溶液滴定草酸溶液 |
| 摇瓶时,使溶液向一个方向做圆周运动,勿使瓶口接触滴定管,溶液也不得溅出。 |
B | 石油分馏时接收馏出物 |
| 为收集到不同沸点范围的馏出物,需要不断更换锥形瓶。 |
C | 测定锌与稀硫酸反应生成氢气的速率 |
| 实验中,需测定的物理量是反应时间和生成氢气的体积。 |
D | 用四氯化碳萃取碘水中的碘 |
| 充分振荡后静置,待溶液分层后,先把上层液体从上口倒出,再让下层液体从下口流出。 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)是一种第VIA族分散稀有元素,主要伴生于铜、镍、铅等金属矿藏中。TeO2属于两性氧化物,难溶于水,易溶于强酸和强碱。工业上可从电解精炼铜的阳极泥(主要成分Cu2Te,还有少量的Ag、Au)中提取碲。其工艺流程如下:
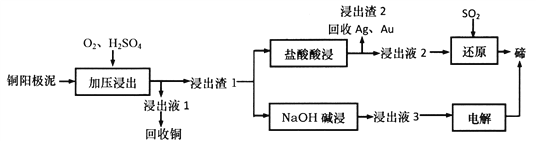
(1)“加压浸出”生成TeO2的离子方程式为________________________,“加压浸出”时控制pH为4.5~5.0,酸性不能过强的原因是_________________________________。
(2)“盐酸酸浸”后将SO2通入浸出液即可得到单质碲,该反应中氧化剂与还原剂物质的量之比为________________,该流程中可循环利用的物质是_____________(填化学式)。
(3)已知:Ksp(Ag2SO4)=7.70×10-5,Ksp(AgC1)=1.80×10-10。盐酸酸浸时,“浸出渣1”中Ag2SO4可充分转化为AgC1。通过计算说明为什么可以实现充分转化_________________。
(4)NaOH碱浸时反应的离子方程式为__________________。流程中,电解过程用石墨为电极得到碲,阴极的电极反应式为__________________________________。
(5)浸出法是工业提取金属常用的方法,某实验小组用1.0mol· L-1的草酸在75℃时浸出镍。随时间变化,不同固液比对镍浸出率的影响曲线如图所示。
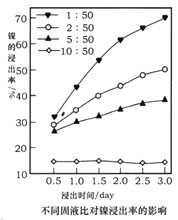
①由图可知,固液比与镍浸出率的关系是______________________。
②除固液比之外,你认为影响金属浸出率的因素还有____________________(至少两项)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
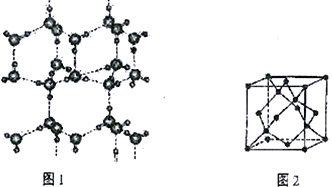
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com