
����Ŀ����������һ�ִ��ж�ṹ��ϸС������ɵ������Ͻ𣬱��㷺�����л�����⻯��Ӧ�Ĵ������Ժ�������(��Ҫ�ɷ�ΪNiS��FeS��SiO2��)Ϊԭ���Ʊ��������Ĺ�����������ͼ��ʾ��
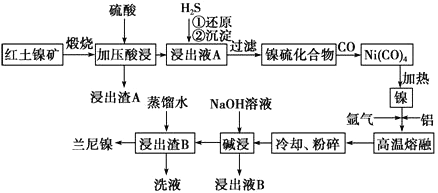
��1��������A����Ҫ�ɷ���_______________���ѧʽ����
��2����֪�����������պ�����Ni2O3������ѹ��������ҺA�к��д���Ni2����д���й���Ԫ�صļ�ѹ����Ļ�ѧ��Ӧ����ʽ_______________________________��
��3�������ҺA��ͨ��H2S���壬�ٻ�ԭ���������漰��Ҫ��Ӧ�����ӷ���ʽ��__________________________________��
��4�����γ�Ni(CO)4�Ĺ����У�̼Ԫ�صĻ��ϼ�û�б仯����Ni(CO)4�е�Ni�Ļ��ϼ�Ϊ________�� ��5�����������Ŀ����ʹ��������ṹ���Ӷ���ǿ��������ǿ�����ԣ��˹����з�����Ӧ�����ӷ���ʽΪ__________________________��
��6������ʱ����Ũ�Ⱦ�Ϊ1.0mol��L-1��FeSO4��NiSO4�Ļ����Һ�еμ�Na2S ���壬��Ni2+ǡ�ó�����ȫʱ��������Һ��c(Fe2+)=______________��
����֪����25�棬Ksp(NiS)=2.0��10-21��Ksp(FeS)=6.0��10-18
����Һ�е�����Ũ�ȡ�10-5 mol��L-1ʱ����Ϊ�����ӳ�����ȫ����
��7������ҺB���Ի��գ������������Ա�ѭ�����á�����ƼĻ������̣�
����ҺB��___________________________________________________________�� ����ͷ��ע����ӷ�Ӧ��Ļ�ѧʽ�ͷ�Ӧ��������(ʾ����![]() )
)
���𰸡� SiO2 2Ni2O3+4H2SO4==4NiSO4+O2��+4H2O H2S+2Fe3+==2Fe2++2H++S�� 0 2Al+2OH-+2H2O=2AlO2-+3H2�� 0.03mol/L ![]()
������������������Ҫ�ɷ�ΪNiS��FeS��SiO2�ȣ����շ���������ԭ��Ӧ�õ�Ni2O3��Fe2O3��SiO2����Ӧ�������������ѹ�����Ni2O3��Fe2O3�ܽ⣬�����ķ�Ӧ��2Ni2O3+4H2SO4=4NiSO4+O2��+4H2O��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��SiO2�������ᷴӦ�����˵õ�������A��SiO2��������ҺA�к�Ni2����Fe3���������ҺA��ͨ�� H2S���壬������ԭ��Ӧ�����ӷ���ʽ�ǣ�H2S+2Fe3��=2Fe2��+2H��+S���������ɳ���NiS�����˵õ�������NiS����ͨ��CO���壬�γ�Ni��CO��4�����ȵõ�������������ʱͨ����������������õ��Ͻ𣬽��Ͻ���ȴ�����飬����Ũ����������Һ����������������Ʒ�Ӧ��������ʹ�����Ͻ������Ľṹ������ҺB�к�ƫ����������������ˮϴ������B���õ���Ʒ����������1��������A����Ҫ�ɷ���SiO2���ѧʽ������2�������������պ�����Ni2O3������ѹ��������ҺA�к��д���Ni2�������Ļ��ϼ۽��ͷ�����ԭ��Ӧ��ֻ�����Ļ��ϼ������ߣ����Բ������������й���Ԫ�صļ�ѹ����Ļ�ѧ��Ӧ����ʽ 2Ni2O3+4H2SO4==4NiSO4+O2��+4H2O����3������ҺA�к�Ni2����Fe3���������ҺA��ͨ��H2S���壬���������н�ǿ�����ԣ������ⷢ����ԭ��Ӧ���ٻ�ԭ���������漰��Ҫ��Ӧ�����ӷ���ʽ��H2S+2Fe3+==2Fe2++2H++S������4�����γ�Ni(CO)4�Ĺ����У�̼Ԫ�صĻ��ϼ�û�б仯,̼Ϊ+2�ۣ���Ϊ-2�ۣ���Ni(CO)4�е�Ni�Ļ��ϼ�Ϊ0�� ��5�����������Ŀ����ʹ��������ṹ�������������Ʒ�Ӧ��������ʹ�����Ͻ������Ľṹ���Ӷ���ǿ��������ǿ�����ԣ��˹����з�����Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O=2AlO2-+3H2������6����Ni2+ǡ�ó�����ȫʱ��Ksp(NiS)=2.0��10-21����c��S2����=2.0��10-21/10-5=2.0��10-16,������Һ��c(Fe2+)=6.0��10-18/2.0��10-16=0.03mol/L����7������ҺB�к�ƫ���������ͨ�����������̼�õ����������������ټ�������ʹ��ֽ�õ����������������ʯ��������̬�µ���������õ������������̿ɱ�ʾΪ������ҺB��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ӫ��Ԫ��֮һ������������Ȼ���й㷺���ڣ�ѭ����ϵ����ͼ��ʾ:
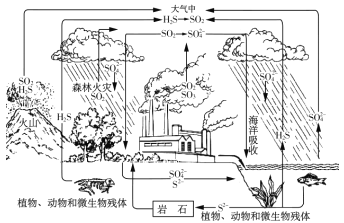
��1����Ȼ��ر���ԭ��ͭ�����ᆳ�������������ú��� CuSO4��Һ�������������������ܵ�ZnS������ת��Ϊͭ���� CuS���� ���û�ѧ�����ʾ ZnS ת��Ϊ CuS �Ĺ��� __________��
��2�� ��ɽ�緢���� H2S �ڴ������з������·�Ӧ��
��2H2S(g)+O2(g) =2S(g) +2H2O(g) ��H=��442.38kJ/mol
��S(g)+O2(g)=SO2(g) �� H=��297.04kJ/mol��
H2S(g)�� O2(g)��Ӧ���� SO2(g)�� H2O(g)���Ȼ�ѧ����ʽ��__________��
��3�� ���� SO2���ŷ����Ѿ�д�� 2018 ���������������� ��ʯȼ��ȼ��ʱ������� SO2�ķ��������������Ⱦ�������ж��ַ��������� SO2���ѳ���
��NaClO ������Һ���շ�����ҵ�Ͽ��� NaClO ������Һ���� SO2��
i.��Ӧ���ӷ���ʽ��__________��
Ϊ���������Ч�ʣ����� Ni2O3��Ϊ�������ڷ�Ӧ�����в������ļ�����ԭ�������м�ǿ����������,�ɼӿ�� SO2�����ա��ô����̵�ʾ��ͼ����ͼ��ʾ��
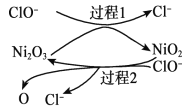
ii.���� 1 �����ӷ���ʽ��__________��
iii.Ca(ClO)2Ҳ����������������Ч���� NaClO ���ã�ԭ����__________��
�ڵ绯ѧ����ij�ֵ绯ѧ����װ������ͼ��ʾ���������ѳ������е�SO2�������Ƶ� H2SO4��
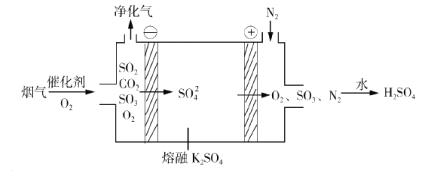
i.�������ŵ��������______��
ii.���������� SO3�ĵ缫��Ӧʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ��绯ѧ��ԭ������һ�ִ���CO2����ɫ�������з�չDZ���ķ�����ͭ��������(In)�Ƚ������Ǹ÷�Ӧ�Ĵ�����
(1)InԪ�ػ�̬ԭ�ӵļ۵����Ų�ʽΪ____________����CuԪ��ͬ���ڣ��һ�̬ԭ����2��δ�ɶԵ��ӵĹ���Ԫ����_________________(��Ԫ�ط���)��
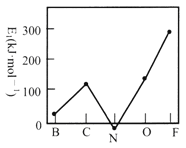
(2)��һ��������(E1)��Ԫ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų����������ڶ����ڲ���Ԫ�ص�E1�仯������ͼ��ʾ���Է���̼Ԫ�ص�E1�ϴ��ԭ��_____________________________��
(3)[PtC14(NH3)2]��Nԭ�ӵ��ӻ���ʽΪ________��������ѧ�����Ͱ���_______(����ĸ)��
a�����Ӽ�b�����ۼ�c��������d����λ��e�����
[PtCl4(NH3)2]��H-N-H��֮��н�______(�>����<����=��)NH3������H-N-H��֮��нǣ�ԭ����__________________________________��
(4)C60����ɲ�ȡ�����ܶѻ���Ȼ���ڿ�϶�в���������ӻ�ó����壬��ͼΪK3C60������������������K+ռ�ݵ���C60Χ�ɵ����������϶��_____��϶����C60���ӵ�ԭ����������ֱ�ΪA(0��0��0)��B(![]() )��C(1��1��1)�ȣ������Aλ��C60���������K+��ԭ���������Ϊ_____________���жϾ����۷е�ߵͣ�C60_________K3C60(�>����<����=��)��
)��C(1��1��1)�ȣ������Aλ��C60���������K+��ԭ���������Ϊ_____________���жϾ����۷е�ߵͣ�C60_________K3C60(�>����<����=��)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ����ͭ����������Һ��Ӧ��Cu��Ag+ ��Cu2+��Ag
B. Ba(OH)2��Һ��H2SO4��Һ��Ӧ��Ba2+ + OH- + H+ + SO42- = BaSO4��+ H2O
C. ���ˮ�еμ�FeCl3��Һ�Ʊ�Fe(OH)3���壺Fe3+��3H2O![]() Fe(OH)3����3H+
Fe(OH)3����3H+
D. ʯ���������ᷴӦ��Ca(OH)2��2H+ = Ca2+��2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ã���������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6 mol��L��1�����ᣬ�����Լ���ѡ��

��д���пհף�
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ������________��A�з�Ӧ�����ӷ���ʽ��________��
��2��ʵ�鿪ʼʱӦ�Ƚ�����a����Ŀ����____________________��
��3����������Fe(OH)2�IJ������̣�_______________________
��4��ʵ����ϣ���b������������һ���ֿ�������ʱB�з�����Ӧ�Ļ�ѧ����ʽΪ____��
��5��ͼ��________(��ܡ����ܡ�)�ϳ�ʱ�俴��Fe(OH)2��ɫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ���֪Fe��HCN��K2CO3��һ�������·������·�Ӧ��Fe+6HCN+2K2CO3=K4Fe(CN)6+H2��+2CO2��+2H2O���ش��������⣺
��1���������Ľ��ܶѻ���ʽΪ_______________������λ��Ϊ_____________________��
��2��HCN ���ӵĽṹʽΪ___________����CN-��Ϊ�ȵ��������������_________________��
��3��K2CO3�������ӵĿռ乹��Ϊ_______________��CO2Ϊ_____________���ӣ�����ԡ��Ǽ��ԡ�����H2O��Oԭ�ӵ��ӻ��������Ϊ_______________��
��4�������K4Fe(CN)6���������ӵĵ����Ų�ʽΪ__________________��
��5��������ѧ����ʽ��C��N��O�ĵ�һ��������С�����˳��Ϊ________________________��
��6�����ľ���ṹģ����ͼ1�����ľ�������ʯ�ľ������ƣ���ͼ2��ˮ����֮������������ӣ���һ����������_____����������������Ϊd nm�������ܶ�(g��cm-3)����ʽΪ___________ ����NA ��ʾ�����ӵ�������ֵ����
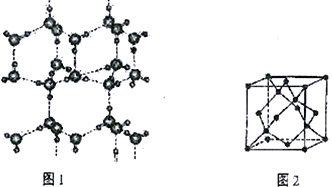
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���¹̶����Ϊ2 L�ܱ������У�������Ӧ��2SO2(g)�� O2(g) ![]() 2SO3(g) ��H <0��n(SO2)��ʱ��ı仯�����
2SO3(g) ��H <0��n(SO2)��ʱ��ı仯�����
ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
������˵����ȷ����
A. ��������������ܶȲ���ʱ��˵���÷�Ӧ�Ѵﵽƽ��״̬
B. ��O2��ʾ0��4 min�ڸ÷�Ӧ��ƽ������Ϊ0.005 mol/(L��min)
C. �������¶ȣ���SO2�ķ�Ӧ���ʻ���ƽ�ⳣ��Kֵ������
D. ƽ��ʱ��ͨ��18O2��ƽ�����ƣ��ٴ�ƽ��ʱ�����ʾ�����18O��O2��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֽƬb���䵽a�У��ɵõ�һ�����������ӷ���ʽ(δ��ƽ)������˵����ȷ����

A. ��Ӧ������S��SO32-��OH-
B. 3mol S�μӷ�Ӧʱ��ת�Ƶĵ�����3NA
C. �������뻹ԭ�������ʵ���֮��Ϊ1:2
D. �÷�Ӧ˵��S2-��SO32-�ڼ�����Һ�п��Դ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ϡ������̼���Ʒ�Ӧ��CO![]() ��2H+ == CO2����H2O
��2H+ == CO2����H2O
B. FeCl2��Һ��ͨ��Cl2��Fe2+ + Cl2 == Fe3+ + 2Cl�D
C. ͭƬ��ϡHNO3��Ӧ��Cu��2H+ == Cu2+ ��H2��
D. ��NaOH��Һ���ն���Cl2��Cl2��2OH��== Cl����ClO����H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com