
����Ŀ����ͼ��ʾװ�ã���������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6 mol��L��1�����ᣬ�����Լ���ѡ��

��д���пհף�
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ������________��A�з�Ӧ�����ӷ���ʽ��________��
��2��ʵ�鿪ʼʱӦ�Ƚ�����a����Ŀ����____________________��
��3����������Fe(OH)2�IJ������̣�_______________________
��4��ʵ����ϣ���b������������һ���ֿ�������ʱB�з�����Ӧ�Ļ�ѧ����ʽΪ____��
��5��ͼ��________(��ܡ����ܡ�)�ϳ�ʱ�俴��Fe(OH)2��ɫ������
���𰸡���м Fe��2H��===Fe2����H2�� �ų�װ���еĿ��� ���ȴ�a���÷�Һ©������Һ���£�ʹA�в�����H2ͨ��B�У�һ��ʱ���ر�a����ƿ��ѹǿ����A��Һ���ص�������B�У�����������ɫ���� 4Fe(OH)2��O2��2H2O===4Fe(OH)3 ��
��������
Ϊ���ܽϳ�ʱ�俴��Fe(OH)2��ɫ������Ӧ�����������ų�װ�������������ȴ�d��Ȼ��ر�d��������������������ѹǿ������������Һѹ��B�������������������ݴ˽��
��1��A��ӦԤ��ʢ�Ź�̬��Ӧ����м������ϡ���ᷴӦ�����������������������ӷ�Ӧ����ʽΪFe+2H+��Fe2++H2����
��2��ʵ�鿪ʼʱ��Ӧ�ȴ���a��ʹ���ɵ�������������ʵ��װ���ж��ų���������ֹ������������������
��3��A�з�Ӧ������Ϊ��֤������������B�к��������ƻ�ϣ�Ҫ��������������ѹǿ�����ʵ�����Ϊ���ȴ�a���÷�Һ©������Һ���£�ʹA�в�����H2ͨ��B�У�һ��ʱ���ر�a����ƿ��ѹǿ����A��Һ���ص�������B�У�����������ɫ������
��4���������������ȶ����ױ������������ɺ��ɫ������������������ʵ����ϣ���b������������һ���ֿ�������ɫ������ת��Ϊ����ɫ���ת��Ϊ���ɫ����Ӧ�ķ���ʽΪ4Fe��OH��2+O2+2H2O��4Fe��OH��3��
��5���������Ϸ�����֪ͼ���ܽϳ�ʱ�俴��Fe(OH)2��ɫ������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ݱ�����1995���ҹ�������Ա�������״κϳ�����Ԫ�ص�һ��ͬλ���䣭239������֪��ԭ�Ӻ�����148�����ӡ�����AԪ�ص�һ��ͬλ�أ�������239��ԭ�Ӻ�����54�����Ӻ�100�����ӣ���AԪ�������ڱ��е�λ����
A. ��3���ڵ���A�� B. ��4���ڵ���A��
C. ��5���ڵ���A�� D. ��3���ڵ���A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʻ�ѧ����й������ں�������ѧ�������ǵ�������ǵ�δ������
��1���Ա���ù�����������������д�����������������̼��Ӧ�Ļ�ѧ����ʽ��__________________________��
��2��С�մ���������ķ��ݼ���д��С�մ�����ˮ�ĵ��뷽��ʽ��_________________��
��3�����ӹ�ҵ����30%��FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�塣д��FeCl3��Һ�����ͭ������Ӧ�����ӷ���ʽ��_________________________________��
��4����ȥNa2CO3��ĩ�л����NaHCO3������ѷ�����_________����ѧ����ʽΪ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Na2O2��Na2O������˵����ȷ����
A. �������Ӹ����Ⱦ�Ϊ1��2
B. ���ǽ��������������ȷ�Ӧ�Ƶ�
C. ��ˮ��Ӧ������ͬ
D. Na2O2��Na2O�������ڿ����У����ղ��ﲻͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��Cu- Li�ɳ���صĹ���ԭ����ͼ��ʾ�����з�ˮϵ���Һ��ˮϵ���Һ������ӹ��������մ�Ƭ( LISICON)����������˵����ȷ����
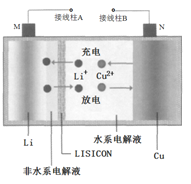
A. �մ�Ƭ����ˮ����ͨ��
B. ��طŵ�ʱ��N���Ϸ���������Ӧ
C. ��س��ʱ��������BӦ�����ֱ����Դ�ĸ�������
D. ��س��ʱ��������ӦΪLi++e-=Li
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�ִ��ж�ṹ��ϸС������ɵ������Ͻ𣬱��㷺�����л�����⻯��Ӧ�Ĵ������Ժ�������(��Ҫ�ɷ�ΪNiS��FeS��SiO2��)Ϊԭ���Ʊ��������Ĺ�����������ͼ��ʾ��
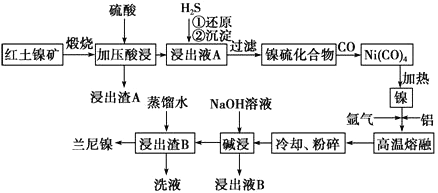
��1��������A����Ҫ�ɷ���_______________���ѧʽ����
��2����֪�����������պ�����Ni2O3������ѹ��������ҺA�к��д���Ni2����д���й���Ԫ�صļ�ѹ����Ļ�ѧ��Ӧ����ʽ_______________________________��
��3�������ҺA��ͨ��H2S���壬�ٻ�ԭ���������漰��Ҫ��Ӧ�����ӷ���ʽ��__________________________________��
��4�����γ�Ni(CO)4�Ĺ����У�̼Ԫ�صĻ��ϼ�û�б仯����Ni(CO)4�е�Ni�Ļ��ϼ�Ϊ________�� ��5�����������Ŀ����ʹ��������ṹ���Ӷ���ǿ��������ǿ�����ԣ��˹����з�����Ӧ�����ӷ���ʽΪ__________________________��
��6������ʱ����Ũ�Ⱦ�Ϊ1.0mol��L-1��FeSO4��NiSO4�Ļ����Һ�еμ�Na2S ���壬��Ni2+ǡ�ó�����ȫʱ��������Һ��c(Fe2+)=______________��
����֪����25�棬Ksp(NiS)=2.0��10-21��Ksp(FeS)=6.0��10-18
����Һ�е�����Ũ�ȡ�10-5 mol��L-1ʱ����Ϊ�����ӳ�����ȫ����
��7������ҺB���Ի��գ������������Ա�ѭ�����á�����ƼĻ������̣�
����ҺB��___________________________________________________________�� ����ͷ��ע����ӷ�Ӧ��Ļ�ѧʽ�ͷ�Ӧ��������(ʾ����![]() )
)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 3.6 g ̼�� 6.4 g ��������ȼ�գ�����Ӧ��ľ������ų� X kJ ��������֪���� C(s)��ȼ������ֵΪ Y kJ��mol��1���� 1 mol C(s)�� O2(g)��Ӧ���� CO(g)�ķ�Ӧ�� ��H Ϊ�� ��
A. -Y kJ/mol B. -(10X��Y) kJ/mol C. -(5X��0.5Y) kJ/mol D. +(10X��Y) kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2.7 g����4.6 g��ͬʱ����������ˮ�г�ַ�Ӧ������Ӧ�����Һϡ�͡�����Ϊ500 mL������˵������ȷ����
A. ������Һ�������Ӻ������ӵ����ʵ���֮��Ϊ1��1
B. �μӷ�Ӧ��ˮ����������������������
C. ������Һ�������Ӻ����������ʵ���֮��Ϊ2��1
D. ��Ӧ�зų��������ڱ�״���µ����Ϊ2.24 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I����һ��������aA��bB![]() cC+dD�ﵽƽ��ʱ������д��
cC+dD�ﵽƽ��ʱ������д��
��1����A��B��C��D�������壬�ڼ�ѹ��ƽ�����淴Ӧ�����ƶ�����a��b��c��d��ϵ��__________________��
��2����֪B��C��D�����壬������A�����ʵ�����ƽ�ⲻ�ƶ���˵��A��__________________����״̬����
��3���������ݻ����䣬��������B������A��ת����__________________����������������С����������������
��4�������Ⱥ�C�İٷֺ�����С��������Ӧ��__________________��Ӧ��������������������������
��5������������ѹǿ���䣬��A��B��C��D�������壬�������г���ϡ�����壬��ѧƽ�������ƶ�����a��b��c��d��ϵ��__________________��
������ҵ��һ��������з�Ӧ�ϳɼ״���CO(g)��2H2(g) ![]() CH3OH(g)��
CH3OH(g)��
��1����һ���¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)��0.5mol��L��1���÷�Ӧ��ƽ�ⳣ��K��__________________��
��2������һ����ɱ�������г���l molCO�� 2mol H2��1mol CH3OH���ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6������÷�Ӧ��__________________(����������������)��Ӧ�����ƶ���
��3�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�˷�Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ���ת���� | CH3OH��Ũ��(mol/L) | �����仯��Q1��Q2��Q3������0�� |
1 | 2molCO��4molH2 | a1�� | c1 | �ų�Q1kJ���� |
2 | 2molCH3OH | a2�� | c2 | ����Q2kJ���� |
3 | 4molCO��8molH2 | a3�� | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ���� __________________��
A�� c1=c2 B��2Q1=Q3 C��2a1=a3 D��a1 +a2 =1 E���÷�Ӧ������2mol CH3OH����ų�(Q1+Q2)kJ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com