
【题目】关于氧化物Na2O2和Na2O,它们说法正确的是
A. 阴阳离子个数比均为1:2
B. 都是金属钠与氧气加热反应制得
C. 与水反应产物相同
D. Na2O2和Na2O长期置于空气中,最终产物不同
科目:高中化学 来源: 题型:
【题目】苏轼的《格物粗谈》中记载:“红柿摘下未熟,每篮用木瓜三枚放入,得气即发,并无涩味。”按照现代科技观点,该文中的“气”是指( )
A.甲烷B.新戊烷C.乙烯D.苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)。
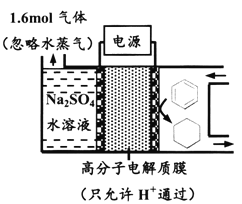
已知储氢装置的电流效率![]() 100%,下列说法不正确的是
100%,下列说法不正确的是
A. 若η=75%,则参加反应的苯为0.8mol
B. 过程中通过C—H键断裂实现氢的储存
C. 采用多孔电极增大了接触面积,可降低电池能量损失
D. 生成目标产物的电极反应式为:C6H6+6e-+6H+=C6H12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】电化学还原技术是一种处置CO2的绿色环保、有发展潜力的方法。铜、铂、铟(In)等金属都是该反应的催化剂。
(1)In元素基态原子的价电子排布式为____________。与Cu元素同周期,且基态原子有2个未成对电子的过渡元素是_________________(填元素符号)。
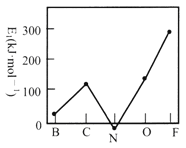
(2)第一电子亲和能(E1)是元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量。第二周期部分元素的E1变化趋势如图所示。试分析碳元素的E1较大的原因_____________________________。
(3)[PtC14(NH3)2]中N原子的杂化方式为________,所含化学键类型包括_______(填字母)。
a.离子键b.共价键c.金属键d.配位键e.氢键
[PtCl4(NH3)2]中H-N-H键之间夹角______(填“>”“<”或“=”)NH3分子中H-N-H键之间夹角,原因是__________________________________。
(4)C60晶体可采取非最密堆积,然后在空隙中插入金属离子获得超导体,如图为K3C60的面心立方晶胞。则K+占据的是C60围成的正四面体空隙和_____空隙,若C60分子的原子坐标参数分别为A(0,0,0),B(![]() ),C(1,1,1)等,则距离A位置C60分子最近的K+的原子坐标参数为_____________。判断晶体熔沸点高低:C60_________K3C60(填“>”“<”或“=”)。
),C(1,1,1)等,则距离A位置C60分子最近的K+的原子坐标参数为_____________。判断晶体熔沸点高低:C60_________K3C60(填“>”“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.氢氧化铝受热分解
D.将锌粒投入CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 金属铜与硝酸银溶液反应:Cu+Ag+ =Cu2++Ag
B. Ba(OH)2溶液和H2SO4溶液反应:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O
C. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 石灰乳与盐酸反应:Ca(OH)2+2H+ = Ca2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。

填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的是________,A中反应的离子方程式是________。
(2)实验开始时应先将活塞a打开,其目的是____________________。
(3)简述生成Fe(OH)2的操作过程:_______________________
(4)实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为____。
(5)图中________(填“能”或“不能”)较长时间看到Fe(OH)2白色沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒温固定体积为2 L密闭容器中,发生反应:2SO2(g)+ O2(g) ![]() 2SO3(g) ΔH <0,n(SO2)随时间的变化如表:
2SO3(g) ΔH <0,n(SO2)随时间的变化如表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A. 当容器中气体的密度不变时,说明该反应已达到平衡状态
B. 用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)
C. 若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D. 平衡时再通入18O2,平衡右移,再次平衡时各物质均含有18O,O2的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 同一原子中,2p、3d、4f能级的轨道数依次增多
B. 电子排布(23V)1s22s22p63s23p63d5违反了洪特规则
C. 原子核外电子的每一个能层最多可容纳的电子数为2n2
D. ![]() 违反了泡利不相容原理
违反了泡利不相容原理
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com