
����Ŀ��I����һ��������aA��bB![]() cC+dD�ﵽƽ��ʱ������д��
cC+dD�ﵽƽ��ʱ������д��
��1����A��B��C��D�������壬�ڼ�ѹ��ƽ�����淴Ӧ�����ƶ�����a��b��c��d��ϵ��__________________��
��2����֪B��C��D�����壬������A�����ʵ�����ƽ�ⲻ�ƶ���˵��A��__________________����״̬����
��3���������ݻ����䣬��������B������A��ת����__________________����������������С����������������
��4�������Ⱥ�C�İٷֺ�����С��������Ӧ��__________________��Ӧ��������������������������
��5������������ѹǿ���䣬��A��B��C��D�������壬�������г���ϡ�����壬��ѧƽ�������ƶ�����a��b��c��d��ϵ��__________________��
������ҵ��һ��������з�Ӧ�ϳɼ״���CO(g)��2H2(g) ![]() CH3OH(g)��
CH3OH(g)��
��1����һ���¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)��0.5mol��L��1���÷�Ӧ��ƽ�ⳣ��K��__________________��
��2������һ����ɱ�������г���l molCO�� 2mol H2��1mol CH3OH���ﵽƽ�ⅼ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6������÷�Ӧ��__________________(����������������)��Ӧ�����ƶ���
��3�������¶Ⱥ��ݻ���ͬ�������ܱ������У�����ͬ��ʽͶ�˷�Ӧ���÷�Ӧ�ﵽƽ�ⅼ���й��������±���
���� | ��Ӧ��Ͷ����� | ��Ӧ���ת���� | CH3OH��Ũ��(mol/L) | �����仯��Q1��Q2��Q3������0�� |
1 | 2molCO��4molH2 | a1�� | c1 | �ų�Q1kJ���� |
2 | 2molCH3OH | a2�� | c2 | ����Q2kJ���� |
3 | 4molCO��8molH2 | a3�� | c3 | �ų�Q3kJ���� |
�����й�ϵ��ȷ���� __________________��
A�� c1=c2 B��2Q1=Q3 C��2a1=a3 D��a1 +a2 =1 E���÷�Ӧ������2mol CH3OH����ų�(Q1+Q2)kJ����
���𰸡� a+b��c+d �����Һ�� ���� ���� a+b��c+d 0.25 L2/mol2�����ʾΪ![]() L2/mol2�� �� ADE
L2/mol2�� �� ADE
��������(1).����ѹǿ��ƽ�������������С�ķ����ƶ�����A��B��C��D�������壬��ѹ��ƽ�����淴Ӧ�����ƶ���˵���淴Ӧ����Ϊ���������С�ķ�����a+b��c+d���ʴ�Ϊ��a+b��c+d��
(2).��֪B��C��D�����壬����A�����ʵ�����ƽ�ⲻ�ƶ���˵��A�ǹ����Һ�壬�����������ʴ�Ϊ�������Һ�壻
(3).�������ݻ����䣬��������B��ƽ�������ƶ�������A��ת�������ʴ�Ϊ������
(4).�����¶ȣ�ƽ�������ȷ�Ӧ�����ƶ������Ⱥ�C�İٷֺ�����С��˵�������¶�ƽ�������ƶ���������ӦΪ���ȷ�Ӧ���ʴ�Ϊ�����ȣ�
(5).A��B��C��D�������壬��������ѹǿ���䣬�������г���ϡ�����壬��������������൱�ڼ�Сѹǿ����ѧƽ�������ƶ���˵������Ӧ����Ϊ�����������ķ�����a+b��c+d���ʴ�Ϊ��a+b��c+d��
II. (1).��һ���¶��£���2 mol CO��6 mol H2����2 L���ܱ������У���ַ�Ӧ�ﵽƽ��ʱ���c(CO)��0.5mol��L��1����������ʽ���У�
CO(g)��2H2(g) ![]() CH3OH(g)
CH3OH(g)
��ʼŨ��(mol��L��1) 1 3 0
ת��Ũ��(mol��L��1) 0.5 1 0.5
ƽ��Ũ��(mol��L��1) 0.5 2 0.5
��ƽ�ⳣ��K=![]() =0.25 L2/mol2���ʴ�Ϊ��0.25 L2/mol2(���ʾΪ
=0.25 L2/mol2���ʴ�Ϊ��0.25 L2/mol2(���ʾΪ![]() L2/mol2)��
L2/mol2)��
(2).CO(g)��2H2(g) ![]() CH3OH(g)������ӦΪ���������С�ķ�Ӧ������һ����ɱ�������г���l molCO�� 2molH2��1molCH3OH���ﵽƽ��ʱ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6������Ӧǰ��������������䣬�ﵽƽ�����������ܶ�����˵����Ӧ�����������С�ķ����ƶ�����������Ӧ�����ƶ����ʴ�Ϊ������
CH3OH(g)������ӦΪ���������С�ķ�Ӧ������һ����ɱ�������г���l molCO�� 2molH2��1molCH3OH���ﵽƽ��ʱ��û��������ܶ���ͬ��ͬѹ����ʼ��1.6������Ӧǰ��������������䣬�ﵽƽ�����������ܶ�����˵����Ӧ�����������С�ķ����ƶ�����������Ӧ�����ƶ����ʴ�Ϊ������
(3).A. 1��2����������Ƚ���������2��2molCH3OHת��Ϊ��˷�Ӧ��൱�ڼ���2molCO��4molH2��������1�ǵ�Ч��������ƽ��ʱ�״���Ũ��c1=c2����A��ȷ��B. 1��3����������Ƚϣ�����3�з�Ӧ������ʵ���Ϊ����1��2�����൱������ѹǿ�����ڷ�ӦCO(g)��2H2(g) ![]() CH3OH(g)��ƽ�������ɼ״��ķ����ƶ�����2Q1<Q3����B����C. 1��3����������Ƚϣ�����3�з�Ӧ������ʵ���Ϊ����1��2�����൱������ѹǿ�����ڷ�ӦCO(g)��2H2(g)
CH3OH(g)��ƽ�������ɼ״��ķ����ƶ�����2Q1<Q3����B����C. 1��3����������Ƚϣ�����3�з�Ӧ������ʵ���Ϊ����1��2�����൱������ѹǿ�����ڷ�ӦCO(g)��2H2(g) ![]() CH3OH(g)��ƽ�������ɼ״��ķ����ƶ�����a1<a3<2a1����C����D. 1��2��������������ͬ��ƽ��״̬�����ҷ�Ӧ�����෴������1+��2=1����D��ȷ��E. 1��2��������������ͬ��ƽ��״̬�����ҷ�Ӧ�����෴����������ת���ĺ�ǡ��Ϊ2mol�����Ը÷�Ӧ������2molCH3OH����ų�(Q1+Q2)kJ����������E��ȷ����ѡADE��
CH3OH(g)��ƽ�������ɼ״��ķ����ƶ�����a1<a3<2a1����C����D. 1��2��������������ͬ��ƽ��״̬�����ҷ�Ӧ�����෴������1+��2=1����D��ȷ��E. 1��2��������������ͬ��ƽ��״̬�����ҷ�Ӧ�����෴����������ת���ĺ�ǡ��Ϊ2mol�����Ը÷�Ӧ������2molCH3OH����ų�(Q1+Q2)kJ����������E��ȷ����ѡADE��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ�ã���������ȡ�۲�Fe(OH)2�ڿ����б���������ɫ�仯��ʵ��ʱ����ʹ����м��6 mol��L��1�����ᣬ�����Լ���ѡ��

��д���пհף�
��1��B��ʢ��һ������NaOH��Һ��A��ӦԤ�ȼ������________��A�з�Ӧ�����ӷ���ʽ��________��
��2��ʵ�鿪ʼʱӦ�Ƚ�����a����Ŀ����____________________��
��3����������Fe(OH)2�IJ������̣�_______________________
��4��ʵ����ϣ���b������������һ���ֿ�������ʱB�з�����Ӧ�Ļ�ѧ����ʽΪ____��
��5��ͼ��________(��ܡ����ܡ�)�ϳ�ʱ�俴��Fe(OH)2��ɫ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ����
A.NaOH��ҺB.KCl��ҺC.Fe(OH)3����D.K2SO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. ͬһԭ���У�2p��3d��4f�ܼ��Ĺ������������
B. �����Ų���23V��1s22s22p63s23p63d5Υ���˺��ع���
C. ԭ�Ӻ�����ӵ�ÿһ���ܲ��������ɵĵ�����Ϊ2n2
D. ![]() Υ��������������ԭ��
Υ��������������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��NO��CO��Ⱦ�ﴦ�����Խ��������й�������Ҫ���塣
��1����NO2(g)+CO(g)==CO2(g)+NO(g)��H1=-234.00kJ/mol
��1/2N2(g)+1/2O2(g)=NO(g)��H2=-89.75kJ/mol
��2NO(g)+O2(g)==2NO2(g)��H3=-112.30kJ/mol��
��NO2�����CO���巴Ӧ��������Ⱦ���������Ȼ�ѧ����ʽΪ______________��
��2��ij�¶��£���10L�ܱ������зֱ����0.1molNO2��0.2molCO��������Ӧ��2NO2(g)+4CO(g)=N2(g)+4CO2(g)����10min��Ӧ�ﵽƽ����������ѹǿ��Ϊԭ����![]() ��
��
��0��10min����CO��ƽ����Ӧ����v(CO)=__________��
���������й۲쵽_____�����жϸ÷�Ӧ�ﵽƽ��״̬��
��Ϊ������Ⱦ�ﴦ��Ч�ʣ���ʼ���Ͷ�ϱ�Ϊ______��
��ƽ�����CO��CO2����Ũ�ȷֱ�����һ������ƽ��_____(���������������������������ƶ���)��

��3���ڸ�Ч������������NH3��ԭNO2������Ⱦ�ﴦ����
����ͬ�����£�ѡ��A��B��C���ִ������з�Ӧ�����ɵ��������ʵ�����ʱ��仯��ͼa�������С����______(��E(A)��E(B)��E(C)��ʾ���ִ����¸÷�Ӧ���)��
���ڴ���A�����²����ͬʱ�䴦��NO2�������¶ȹ�ϵ��ͼb����˵��ͼ��������������С��ԭ��________(������¶ȷ�Χ�ڴ�Ч����ͬ)��

��4�����������ں���NO2��������ˮ�м�����������۵Ķ����̿��������ˮ�ľ������Խ�ϵ缫��Ӧ˵�������̿����Ҫ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ϡ������̼���Ʒ�Ӧ��CO![]() ��2H+ == CO2����H2O
��2H+ == CO2����H2O
B. FeCl2��Һ��ͨ��Cl2��Fe2+ + Cl2 == Fe3+ + 2Cl�D
C. ͭƬ��ϡHNO3��Ӧ��Cu��2H+ == Cu2+ ��H2��
D. ��NaOH��Һ���ն���Cl2��Cl2��2OH��== Cl����ClO����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ը����Ϊԭ�ϣ��õ�ⷨ�Ʊ��ظ���ص�ʵ��װ����ͼ������˵������ȷ����

A. �������ң������ĵ缫��ӦΪ��2H2O+2e-=2OH-+H2��
B. �������ң�ͨ�����Һ���ɻ�ɫ��Ϊ��ɫ������Ϊ������H+Ũ������ʹƽ��2CrO42-+2H+ Cr2O72-+H2O�����ƶ�
C. ���Ʊ������ܷ�Ӧ�Ļ�ѧ����ʽΪ��4K2CrO4+4H2O![]() 2K2Cr2O4+4KOH+2H2��+O2��
2K2Cr2O4+4KOH+2H2��+O2��
D. �ⶨ����Һ��K��Cr�ĺ�������K��Cr�����ʵ���֮��Ϊd�����ʱ����ص�ת����Ϊ2-d
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
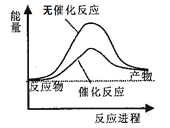
A. ��ͼ�ɱ�ʾˮ�ֽ�����е������仯
B. ��2C(s)+O2(g)=2CO(g)��=221.0kJ/mol����̼��ȼ����Ϊ110.5kJ/mol
C. ��Ҫ���ȵķ�Ӧһ�������ȷ�Ӧ���������ܷ����ķ�Ӧһ���Ƿ��ȷ�Ӧ
D. ��֪I:��ӦH2(g)+Cl2(g)=2HCl(g)��=akJ/mol��II:![]() ��a��b��c��������,��Ͽ�1mol HCl�����������Ϊ(abc)kJ/mol
��a��b��c��������,��Ͽ�1mol HCl�����������Ϊ(abc)kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2�������ǹ�������ձ��ע�����⡣
��1��CO2�ĵ���ʽ��______��
��2��CO2�ڴ��������¿���ֱ��ת��Ϊ�Ҷ����ͼ״���������Ӧ�¶ȹ��ߣ��Ҷ�������ȼ��������Ҵ���
![]()
��ȡ�Ҷ����ķ�Ӧ���̿ɷ�Ϊ����2����
��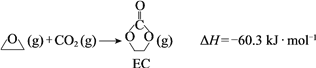
��EC���������Ҷ�����״�
![]()
�� ���������Ȼ�ѧ����ʽ��______��
�� �о���Ӧ�¶ȶ�EC�����Ӱ�죨��Ӧʱ���Ϊ4Сʱ����ʵ�����ݼ��±���
��Ӧ�¶�/ �� | ECת����/ % | ����/ % | |
�Ҷ��� | �״� | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
���ϱ���֪���¶�Խ����EC��ת����Խ����ԭ����______���¶����ߵ�220 ��ʱ���Ҷ����IJ��ʷ������ͣ�ԭ����______��
��3����ϡ�������������Һ�����CO2����ȡ�״���װ������ͼ��ʾ���缫a�ӵ�Դ��______���������������������������ɼ״��ĵ缫��Ӧʽ��______��

��4��CO2���ȶ�����������Ϊʵ��CO2�Ļ�ѧ���ã������о������������______������ţ���
a��ѡ��������ķ�Ӧ���CO2��Ӧ��õ�������������
b�����õ��ܡ����ܻ����ܻCO2����
c��ѡ���Ч�Ĵ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com