
【题目】以铬酸钾为原料,用电解法制备重铬酸钾的实验装置如图,下列说法不正确的是

A. 在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向左移动
C. 该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O4+4KOH+2H2↑+O2↑
2K2Cr2O4+4KOH+2H2↑+O2↑
D. 测定阳极液中K和Cr的含量。若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d
【答案】B
【解析】A. 在阴极室,溶液中的阳离子放电,由于氢离子的放电能力强于钾离子,故发生的电极反应为2H2O+2e-=2OH-+H2↑,A正确;B. 在阳极室,水电离的OH-放电从而破坏了水的电离平衡,阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向右移动,故通电后溶液逐渐由黄色变为橙色,B不正确;C. 综合分析阴、阳两极的电极反应以及2CrO42-+2H+ Cr2O72-+H2O可知,该制备过程总反应的化学方程式为4K2CrO4+4H2O ![]() 2K2Cr2O4+4KOH+2H2↑+O2↑,C正确;D. 阳极的总反应为4CrO42- -4 e-= 2Cr2O72-+ O2↑,由此可知,转移4mol电子时,有4molK+从阳极迁移到阴极,可得关系式e-~CrO42- ~ K+。在反应前阳极K2CrO4中K与Cr的物质的量之比为2:1,若反应后测得阳极K与Cr的物质的量之比为d,设铬酸钾的转化率为
2K2Cr2O4+4KOH+2H2↑+O2↑,C正确;D. 阳极的总反应为4CrO42- -4 e-= 2Cr2O72-+ O2↑,由此可知,转移4mol电子时,有4molK+从阳极迁移到阴极,可得关系式e-~CrO42- ~ K+。在反应前阳极K2CrO4中K与Cr的物质的量之比为2:1,若反应后测得阳极K与Cr的物质的量之比为d,设铬酸钾的转化率为![]() 、反应前铬酸钾的物质的量为1mol,则CrO42-反应后的变化量为
、反应前铬酸钾的物质的量为1mol,则CrO42-反应后的变化量为![]() 、K+的迁移量也是
、K+的迁移量也是![]() ,所以,
,所以,![]() ,解之得,此时铬酸钾的转化率
,解之得,此时铬酸钾的转化率![]() 2-d ,D正确。本题选B。
2-d ,D正确。本题选B。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知 3.6 g 碳在 6.4 g 的氧气中燃烧,至反应物耗尽,并放出 X kJ 热量。已知单质 C(s)的燃烧热数值为 Y kJ·mol-1,则 1 mol C(s)与 O2(g)反应生成 CO(g)的反应热 ΔH 为( )
A. -Y kJ/mol B. -(10X-Y) kJ/mol C. -(5X-0.5Y) kJ/mol D. +(10X-Y) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,存在X→Y或Y→Z不能通过一步反应完成转化的一组是
选项 | X | Y | Z |
A | Al | NaAlO2(aq) | Al(OH)3 |
B | MgO | MgCl2(aq) | Mg |
C | H2O(g) | Fe3O4 | Fe |
D | NaOH(aq) | Na2CO3(aq) | NaHCO3(aq) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.在一定条件下aA+bB![]() cC+dD达到平衡时,请填写:
cC+dD达到平衡时,请填写:
(1)若A、B、C、D都是气体,在加压后平衡向逆反应方向移动,则a、b、c、d关系是__________________。
(2)已知B、C、D是气体,现增加A的物质的量,平衡不移动,说明A是__________________(填状态)。
(3)若容器容积不变,加入气体B,气体A的转化率__________________(填“增大”“减小”或“不变”)。
(4)若加热后,C的百分含量减小,则正反应是__________________反应(填“放热”或“吸热”)。
(5)若保持容器压强不变,且A、B、C、D都是气体,向容器中充入稀有气体,则化学平衡正向移动,则a、b、c、d关系是__________________。
Ⅱ.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)。
CH3OH(g)。
(1)在一定温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.5mol·L-1。该反应的平衡常数K=__________________。
(2)若在一体积可变的容器中充入l molCO、 2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向__________________(填“正”、“逆”)反应方向移动。
(3)若在温度和容积相同的三个密闭容器中,按不同方式投人反应物,测得反应达到平衡吋的有关数据如下表:
容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度(mol/L) | 能量变化(Q1、Q2、Q3均大于0) |
1 | 2molCO和4molH2 | a1% | c1 | 放出Q1kJ热量 |
2 | 2molCH3OH | a2% | c2 | 吸收Q2kJ热量 |
3 | 4molCO和8molH2 | a3% | c3 | 放出Q3kJ热量 |
则下列关系正确的是 __________________。
A. c1=c2 B.2Q1=Q3 C.2a1=a3 D.a1 +a2 =1 E.该反应若生成2mol CH3OH,则放出(Q1+Q2)kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是
A. 2Na + 2H2O =2NaOH + H2↑ B. 2Na + O2![]() Na2O2
Na2O2
C. 2Na2O2 + 2CO2=2Na2CO3+O2 D. NaHCO3+HCl=NaCl+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能够大量共存的是( )
A.Fe3+ , NH4+ , NO3﹣ , OH﹣
B.NH4+ , OH﹣ , Cl﹣ , Al3+
C.Fe2+ , H+ , NO3﹣ , Cl﹣
D.SO42﹣ , OH﹣ , Cl﹣ , Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锰(MnCO3)是一种高性能磁性材料。以软锰矿粉(主要含MnO2,还含有少量的Fe2O3、Al2O3等杂质)为原料制取MnCO3的流程如下:

已知:“沉锰”反应为:Mn2+ + 2HCO![]() == MnCO3↓+ H2O + CO2↑
== MnCO3↓+ H2O + CO2↑
(1)“酸浸”时发生的主要反应为:2Fe2+ + MnO2+ 4H+ == 2Fe3+ + Mn2+ + 2H2O。除此以外,还发生的反应离子方程式为________。(任写一个)
(2)“沉锰”工序中,实验测得MnCO3的产率与溶液pH、反应时间t的关系如图所示。反应要控制pH在7左右的理由是_________。(答两点)

(3)“过滤Ⅱ”所得滤液中溶质的主要成分是_________。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.800g软锰矿样品,加入4.020 g草酸钠(Na2C2O4)固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,过量的Na2C2O4用0.2000 mol/L高锰酸钾溶液进行滴定,当滴入30.00mL溶液时恰好完全反应。已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:MnO2 + C2O![]() + 4H+
+ 4H+ ![]() Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O
Mn2+ + 2CO2↑+ 2H2O,MnO4-+ C2O![]() + H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
+ H+ — Mn2+ + CO2↑+ H2O (未配平)。求该软锰矿中二氧化锰的质量分数_________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2可以合成甲醇,反应原理为CO(g)+2H2(g)═CH3OH(g).一定条件下,在容积为V L的密闭容器中充入a mol CO与2a mol H2合成甲醇,平衡转化率与温度、压强的关系如图所示。
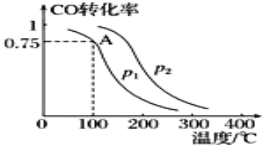
(1)p1___p2(填“>”、“<”或“=”),理由是___.
(2)该甲醇合成反应在A点的平衡常数K=___(用a和V表示).
(3)该反应达到平衡时,反应物转化率的关系是CO___H2.(填“>”、“<”或“=”)
(4)下列措施中能够同时满足增大反应速率和提高CO转化率的是___(填字母).
A. 使用高效催化剂 B.降低反应温度
C. 增大体系压强 D.不断将CH3OH从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组对反应2X (g) + Y(g)2Z(g)进行对照实验(见下表)。下列有关说法错误的是( )
实验序号 | 反应温度 | c(X)mol/L | c(Y)mol/L |
1 | 400℃ | 2 | 1 |
2 | 400℃ | 2 | 2 |
A.该反应为可逆反应B.探究温度对反应速率的影响
C.探究浓度对反应速率的影响D.实验2的反应速率较快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com