
����Ŀ������ѧ-ѡ��5:�л���ѧ������������̹��һ�����Ʒζ�����Ѫѹҩ��,�ɷ��㻯����A�ϳ����м���G��һ�ֺϳ�·������:
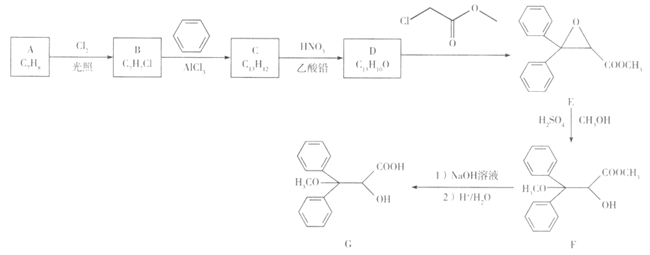
��֪:C�ĺ˴Ź�������ֻ��4 ��壬Dֻ��3��塣
�ش���������:
(1)A�Ļ�ѧ������_______��G�к��������ŵ�������______��
(2)C�Ľṹ��ʽ��______��D�Ľṹ��ʽ��______ ��
(3)B��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��____________��
(4)�������������ķ��㻯����X��E��ͬ���칹�壬X������������ˮ��ֻ����һ���л����X��____�֣����к˴Ź���������3���,�����֮��Ϊ3:2:2�Ľṹ��ʽΪ______ ��
(5)д���ü���ͱ�Ϊԭ���Ʊ�������2��4��6-������������ĺϳ�·��: ______(�����Լ���ѡ)��
���𰸡� �ױ� �ѻ����ǻ����Ȼ� ![]()
![]() 4
4 
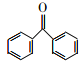
��������(1)A��B�ķ�Ӧ��A�������ڹ��������·�����ȡ����Ӧ��A�ķ���ʽΪC7H8�����ڷ���������AΪ�ױ�����G�Ľṹ��ʽ֪��G�к��������ŵ��������ѻ����ǻ����Ȼ���
(2)B��C�ķ�Ӧ��![]() �ͱ����Ȼ����������������·�����ȡ����Ӧ����C�Ľṹ��ʽ��
�ͱ����Ȼ����������������·�����ȡ����Ӧ����C�Ľṹ��ʽ��![]() ����D�ķ���ʽ(C13H10O)��C��D�ķ�Ӧ�ص����֪D�Ľṹ��ʽ��
����D�ķ���ʽ(C13H10O)��C��D�ķ�Ӧ�ص����֪D�Ľṹ��ʽ��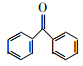 ��������ȷ��Ϊ��
��������ȷ��Ϊ��![]() ��
�� ��
��
(3) ![]() ��NaOH��Һ��Ӧ��±��������������ˮ��Һ�з�����ˮ�ⷴӦ����ѧ����ʽ��
��NaOH��Һ��Ӧ��±��������������ˮ��Һ�з�����ˮ�ⷴӦ����ѧ����ʽ��![]() ��
��
(4)E�ķ���ʽΪC16H14O3��X��E��ͬ���칹�壬��������������������������ˮ��ֻ����һ���л������������X�У�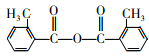 ��
��![]()
 ��
��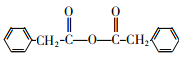 ��4�֣�
��4�֣�
���к˴Ź���������3���,�����֮��Ϊ3:2:2�Ľṹ��ʽΪ ��
��
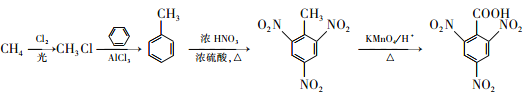
(5)����ϳ�ԭ�������A��B��C�ķ�Ӧ�����ͷ�Ӧԭ�����ɼ������Ƶ�һ�ȼ��飬��һ�ȼ������Ƶüױ����ױ���Ũ���ᡢŨ���ᷢ��������Ӧ����2��4��6-�������ױ���������������ɣ�
�ϳ�·��Ϊ: 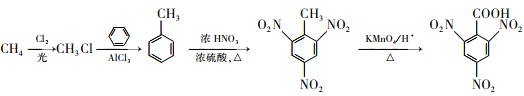 ��
��


 ���Ӣ��������ϵ�д�
���Ӣ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ѧ����ѡ��3�����ʽṹ�����ʡ��绯ѧ��ԭ������һ�ִ���CO2����ɫ�������з�չDZ���ķ�����ͭ��������(In)�Ƚ������Ǹ÷�Ӧ�Ĵ�����
(1)InԪ�ػ�̬ԭ�ӵļ۵����Ų�ʽΪ____________����CuԪ��ͬ���ڣ��һ�̬ԭ����2��δ�ɶԵ��ӵĹ���Ԫ����_________________(��Ԫ�ط���)��
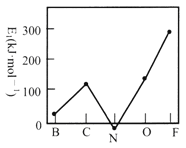
(2)��һ��������(E1)��Ԫ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų����������ڶ����ڲ���Ԫ�ص�E1�仯������ͼ��ʾ���Է���̼Ԫ�ص�E1�ϴ��ԭ��_____________________________��
(3)[PtC14(NH3)2]��Nԭ�ӵ��ӻ���ʽΪ________��������ѧ�����Ͱ���_______(����ĸ)��
a�����Ӽ�b�����ۼ�c��������d����λ��e�����
[PtCl4(NH3)2]��H-N-H��֮��н�______(�>����<����=��)NH3������H-N-H��֮��нǣ�ԭ����__________________________________��
(4)C60����ɲ�ȡ�����ܶѻ���Ȼ���ڿ�϶�в���������ӻ�ó����壬��ͼΪK3C60������������������K+ռ�ݵ���C60Χ�ɵ����������϶��_____��϶����C60���ӵ�ԭ����������ֱ�ΪA(0��0��0)��B(![]() )��C(1��1��1)�ȣ������Aλ��C60���������K+��ԭ���������Ϊ_____________���жϾ����۷е�ߵͣ�C60_________K3C60(�>����<����=��)��
)��C(1��1��1)�ȣ������Aλ��C60���������K+��ԭ���������Ϊ_____________���жϾ����۷е�ߵͣ�C60_________K3C60(�>����<����=��)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���¹̶����Ϊ2 L�ܱ������У�������Ӧ��2SO2(g)�� O2(g) ![]() 2SO3(g) ��H <0��n(SO2)��ʱ��ı仯�����
2SO3(g) ��H <0��n(SO2)��ʱ��ı仯�����
ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
������˵����ȷ����
A. ��������������ܶȲ���ʱ��˵���÷�Ӧ�Ѵﵽƽ��״̬
B. ��O2��ʾ0��4 min�ڸ÷�Ӧ��ƽ������Ϊ0.005 mol/(L��min)
C. �������¶ȣ���SO2�ķ�Ӧ���ʻ���ƽ�ⳣ��Kֵ������
D. ƽ��ʱ��ͨ��18O2��ƽ�����ƣ��ٴ�ƽ��ʱ�����ʾ�����18O��O2��ת���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֽƬb���䵽a�У��ɵõ�һ�����������ӷ���ʽ(δ��ƽ)������˵����ȷ����

A. ��Ӧ������S��SO32-��OH-
B. 3mol S�μӷ�Ӧʱ��ת�Ƶĵ�����3NA
C. �������뻹ԭ�������ʵ���֮��Ϊ1:2
D. �÷�Ӧ˵��S2-��SO32-�ڼ�����Һ�п��Դ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����з�ɢϵʱ���ܹ۲쵽�����ЧӦ����
A.NaOH��ҺB.KCl��ҺC.Fe(OH)3����D.K2SO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25 ��ʱ�Ĵ�ˮ��ͨ��һ������HCl���壬����Һ��pH��2ʱ������ˮ�������c��H������
A. 1��10��2 mol��L��1 B. 1��10��8 mol��L��1
C. 1��10��12 mol��L��1 D. 1��10��4 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. ͬһԭ���У�2p��3d��4f�ܼ��Ĺ������������
B. �����Ų���23V��1s22s22p63s23p63d5Υ���˺��ع���
C. ԭ�Ӻ�����ӵ�ÿһ���ܲ��������ɵĵ�����Ϊ2n2
D. ![]() Υ��������������ԭ��
Υ��������������ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ȷ����
A. ϡ������̼���Ʒ�Ӧ��CO![]() ��2H+ == CO2����H2O
��2H+ == CO2����H2O
B. FeCl2��Һ��ͨ��Cl2��Fe2+ + Cl2 == Fe3+ + 2Cl�D
C. ͭƬ��ϡHNO3��Ӧ��Cu��2H+ == Cu2+ ��H2��
D. ��NaOH��Һ���ն���Cl2��Cl2��2OH��== Cl����ClO����H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������д����ĵ⣬ÿ1000g�����к���5g���ҡ�ʵ�����У��Ӻ�������ȡ��IJ�����������ͼ��

(1)�۵IJ���������________________���ݵIJ���������__________________��
(2)�Լ�b���������Ȼ�̼����������_________________________(������)��
(3)���ڢݵIJ������裬����˵����ȷ����_____________________(����ĸ)��
A. ��Һ��ʱ����Ҫ��ת��Һ©��
B. �����Һ�����Һ©������������̨�ϣ�������Һ
C. ��Һʱ�����²�Һ�嶼Ҫ�ӷ�Һ©���¿������ձ��ڱ����벻ͬ���ձ�
D. ��Һʱ����Ҫ������Һ©���Ϸ��IJ�������ʹ��Һ©���ܷ�
(4)�Լ�a��ѡ��ϡ�����ữ�Ĺ���������Һ����ȫ����ܷ�Ӧ�����ӷ���ʽ��___I�D +____H2O2+______==____I2+______��(ϵ��Ϊ��1��ʱ��Ҫд��1��)
(5)ij��ȤС�����ʵ�鷽�����Ӻ�I2��CCl4��Һ�з���I2��CCl4����֪��
�۵� | �е� | |
I2 | 114�� | 184�� |
CCl4 | -23�� | 77�� |
��С��ͬѧ�������ϣ�����������ķ�������װ������ͼװ�ã�����B��������_____��ͼ����һ�����Դ���Ӧ����Ϊ_______________________________________��
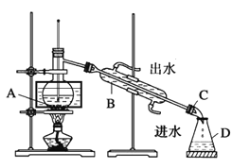
�ڸ�С��ͬѧ����װ�ô������ʵ�顣��80��ˮԡ����Ƭ�̣��۲쵽��ƿ�г�����ɫ��������ƿ��Ҳ��ʼ�ռ���dz�Ϻ�ɫ��Һ��������ƿ�в���������I2��ͨ��ʵ��ó����ۣ���ѹ�µ�����__________________________(�����ʺ����������ʺ���)����I2��CCl4��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com