
【题目】在一个固定容积的密闭容器中,保持一定温度进行如下反应:H2(g)+Br2(g) ![]() 2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x mol、y mol、z mol(均不为0)且保持平衡时,各组分百分含量都不变。以下推断中一定正确的是( )
2HBr(g),已知加入1 mol H2和2 mol Br2达到平衡后,生成了a mol HBr。在相同条件下,若起始时加入的H2、Br2、HBr分别为x mol、y mol、z mol(均不为0)且保持平衡时,各组分百分含量都不变。以下推断中一定正确的是( )
①x,y,z应满足的关系为:4x+z=2y
②达到平衡时HBr的物质的量为(x+y+z)/3 amol
③达到平衡时HBr的物质的量为a mol
④x、y、z应满足的关系为x+y=z
A. ①② B. ②③ C. ③④ D. ①②③
【答案】A
【解析】平衡时各组分百分含量都不变。应是等效平衡。反应前后气体的物质的量不变,如对体系加压(或减压),或者按比例加大(或减小)各反应物物质的量,平衡不会发生移动,各物质的质量分数保持不变(浓度要发生改变),即本题中加入各物质如果完全转化为Br2和H2,只要满足Br2和H2的物质的量比为2∶1就与原平衡相同。①x,y,z满足的关系为:4x+z=2y,就满足Br2和H2的物质的量比为2∶1,选项①正确;②达到平衡时HBr的物质的量为(x+y+z)/3 amol,也满足Br2和H2的物质的量比为2∶1,选项②正确;③达到平衡时HBr的物质的量为a mol,无法确定Br2和H2的物质的量比,选项③不正确;④x、y、z满足的关系为x+y=z很难,且无法确定Br2和H2的物质的量比,选项④不正确。答案选A。


科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟足量的铁粉反应时,为了减缓化学反应速率,且不影响生成的H2的总量,可向盐酸中加入适量的 ( )
A. NaOH B. CH3COOH C. 硫酸钾固体 D. CH3COONa固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在容积不变的密闭容器中加入P、Q进行反应P(g)+2Q(g)![]() 3R(g)+S(l),说明该反应达到平衡的是
3R(g)+S(l),说明该反应达到平衡的是
A.反应容器中气体的平均摩尔质量不再改变
B.反应容器中P、Q、R、S四者共存
C.2v正(Q)=3 v逆(R)
D.反应容器中压强不随时间变化而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硅及二氧化硅的说法中正确的是( )
A. 高纯度的硅可用于制造计算机芯片 B. SiO2的物理性质与CO2类似
C. 熔融烧碱样品使用的器皿是石英坩埚 D. 光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】硼与铝为同族元素。据报道硼和镁形成的化合物刷新了金属化合物超导的最高纪录,硼、镁及其化合物在工农业生产中应用广泛;硼酸(H3BO3)是极弱的一元弱酸。硼镁矿主要成分为Mg2B2O5.H2O,用硼镁矿、碳铵法实验室制备硼酸的主要流程如下:
![]()

请回答:
(1)步骤①中实验室需要把硼镁矿放在 仪器中焙烧(填实验仪器)。
(2)步骤③中采用减压过滤,该小组同学所用的装置如右图所示,若实验过程中发现倒吸现象,应采取最简单的实验操作是 ;从NH4H2BO3溶液获得硼酸晶体蒸发浓缩、冷却结晶、抽滤、洗涤、干燥获得硼酸晶体,下列实验条件容易使得到的硼酸晶体有较大颗粒的是 。
A.较高温度下快速蒸发
B.用冰水冷却 NH4H2BO3溶液
C.采用较稀的NH4H2BO3溶液
(3)硼酸是极弱的一元弱酸,用离子方程式表示硼酸溶液显酸性的原因 ;硼酸溶解度如下图所示,从操作③中获得H3BO3晶体需要洗涤、干燥,洗涤过程中需要用 (填“冷水”或“热水”),你的理由是 ;


(4)测定硼酸晶体纯度的试验方法是,取0.5000g样品与锥形瓶中,滴加甘油,微热使样品溶解,迅速冷却至室温,滴加指示剂,用NaOH标准溶液滴定至15.80ml时到达终点。已知:每1.00mlNaOH滴定液相当于30.92mg的H3BO3,则该样品中H3BO3的质量分数为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使反应N2+3H2 ![]() 2NH3发生,有关说法正确的是( )
2NH3发生,有关说法正确的是( )
A. 达到化学平衡时,N2将完全转化为NH3
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是

A. ①是其它条件一定时,反应速率随温度变化的图象,正反应△H<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图象,曲线a是使用催化剂的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图象,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是
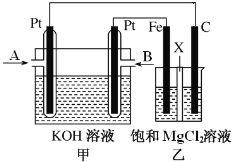
A.甲中A处通入CH4,电极反应式为CH4+10OH8e![]() +7H2O
+7H2O
B.乙中电解MgCl2溶液的总反应为2Cl+2H2O![]() Cl2↑+H2↑+2OH
Cl2↑+H2↑+2OH
C.理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
D.甲、乙中电解质溶液的pH都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸生产中,500℃时,NH3和O2可能发生如下反应:
① 4NH3 (g) + 5O2 (g) ![]() 4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
4NO (g) + 6H2O (g) △H= - 9072 kJ·mol-1K= 1.1×1026
② 4NH3 (g) + 4O2 (g) ![]() 2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
2N2O (g) + 6H2O (g) △H= - 1105 kJ·mol-1K= 4.4×1028
③ 4NH3 (g) + 3O2 (g) ![]() 2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
2N2 (g) + 6H2O (g) △H= - 1269 kJ·mol-1K= 7.1×1034
其中,②、③是副反应。若要减少副反应,提高NO的产率,最合理的措施是
A.减小压强 B.降低温度
C.增大O2浓度 D.使用合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com