
【题目】已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是
A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生D.该体系中,Ksp(CaF2)=![]()
【答案】C
【解析】
A.HF酸为弱酸,不能完全电离,则25℃时,0.1molL-1HF溶液中pH>1,故A错误;
B.Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故B错误;
C.向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,c(Ca2+)=0.1 molL-1,c(F-)=![]() =
=![]() =6×10-3mol/L,则Qc=c2(F-)c(Ca2+)=(6×10-3mol/L)2×0.1 molL-1=3.6×10-6>Ksp(CaF2),说明有沉淀产生,故C正确;
=6×10-3mol/L,则Qc=c2(F-)c(Ca2+)=(6×10-3mol/L)2×0.1 molL-1=3.6×10-6>Ksp(CaF2),说明有沉淀产生,故C正确;
D.Ka(HF)=3.6×10-4 molL-1,溶度积常数Ksp(CaF2)=1.46×10-10mol3L-3,Ka×Ksp≠1,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】(1)(CH3)3 NH+和![]() 可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________(填“大”或“小”),可用作___________(填序号)。
可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂___________(填“大”或“小”),可用作___________(填序号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料 d.绝热材料
(2)为了研究在纳米级的空间中水的结冰温度,科学家对不同直径碳纳米管中水的结冰温度进行分析。如图是四种不同直径碳纳米管中的冰柱结构及结冰温度,冰柱的大小取决于碳纳米管的直径。水在碳纳米管中结冰的规律是_________________。
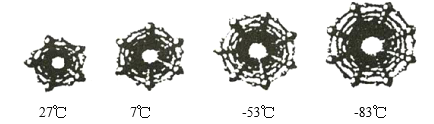
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子。
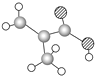
该物质的结构简式为_______________.该物质中所含官能团的名称为______________________.
(2)下列各组物质: ① O2和O3 ② H2、D2、T2 ③ 12C和14C ④ CH3CH2CH2CH3 和 (CH3)2CH2CH3 ⑤乙烷和丁烷 ⑥CH3CH2CH2CH(C2H5)CH3和CH3CH2CH2CH(CH3)C2H5 互为同系物的是__________, 互为同分异构体的是________,互为同位素的是________, 互为同素异形体的是_________,是同一物质的是__________。
(3)酚酞是常用的酸碱指示剂,其结构简式如图所示:
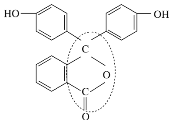
①酚酞的分子式为___________________________________。
②从结构上分析酚酞可看作_____________________。
A.烯烃 B.芳香化合物
C.醇类物质 D.酚类物质
E.醚类物质 F.酯类物质
③酚酞结构简式中画虚线的地方是醚键吗?_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)及其化合物广泛应用于电子、医药等领域。一种以含铋矿石辉铋矿(主要成分为Bi2S3,含少量杂质PbO2等)为原料,采用湿法冶金制备铋单质的工艺流程如下:
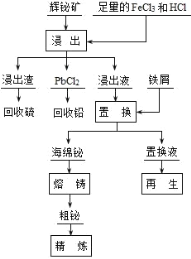
已知:PbCl2是一种难溶于冷水,易溶于热水的白色固体。 回答下列问题:
(1)铋(Bi)位于ⅤA族,铋的氢化物的热稳定性______氨气(填“大于”或“小于”)。
(2)“浸出”时,为了提高浸出速率,可采用的措施有______(任写一条)
(3)加热浸出时,PbO2 生成 PbCl2 和一种气体,此反应的化学方程式为______, 从产物中分离回收 PbCl2 的步骤是______、洗涤、干燥。从保护环境和原料循环利 用的角度,请指出上述工艺流程中可以采取的措施为______。
(4)电解精炼粗铋时必须补充含 Bi3+浓度高的电解液。可用粗铋、铅条作为两个电极,铅条外用素烧 的陶瓷坩埚作隔膜(Bi3+不能透过,H+能透过),电解液开始时为盐酸和食盐的混合液。则粗铋为电解池的 ______极,电解总反应为______。
(5)25℃时,向浓度均为 0.02mol·L-1 的 Cu2+、Bi3+的混合溶液中滴加 Na2S 溶液(设溶液体积增加 1倍),使 Cu2+恰好沉淀完全即溶液中 c(Cu2+)=1×10-5 mol·L-1,此时是否有 Bi2S3 沉淀生成______(列式计算说明)。(已知:25℃时,Ksp(CuS)=6.0×10-36、Ksp(Bi2S3)=1.8×10-99)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是( )
A.![]() +H2O
+H2O![]()
![]() +OH- 用热的纯碱溶液清洗油污
+OH- 用热的纯碱溶液清洗油污
B.Al3++3H2O![]() Al(OH)3(胶体)+3H+ 明矾净水
Al(OH)3(胶体)+3H+ 明矾净水
C.TiCl4+(x+2)H2O(过量)![]() TiO2·xH2O↓+4HCl制备TiO2纳米粉
TiO2·xH2O↓+4HCl制备TiO2纳米粉
D.SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 NH4Cl、盐酸、NaClO2 为原料制备 ClO2 的过程如下图所示,下列说法不正确的是
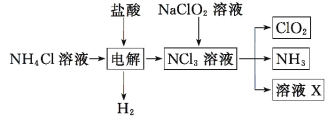
A.X 中大量存在的阴离子有 Cl-和 OH-B.NCl3 的键角比 CH4 的键角大
C.NaClO2 变成 ClO2 发生了氧化反应D.制取 3 mol ClO2 至少需要 0.5mol NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇(C2H5OH)燃料电池是一种新型电池,其中采用质子(H+)溶剂,在200℃左右时供电,电池总反应为C2H5OH+3O2=2CO2+3H2O,该电池的工作原理如图所示。下列说法正确的是( )
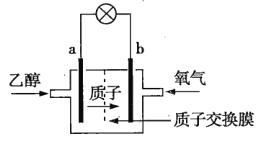
A.通入乙醇的a电极是正极
B..氧气在b电极上发生氧化反应
C.电池工作时,质子向电池的负极迁移
D.电池工作时,电流由b极沿导线流向a极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾消毒片主要成分为KMnO4,可外用消炎杀菌。用某软锰矿(主要成分是MnO2,还含有A12O3、SiO2等杂质)制备KMnO4的流程图如下:
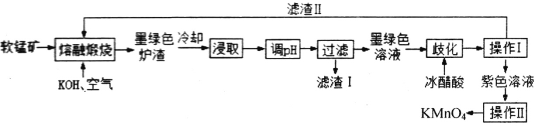
已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性且能发生可逆的歧化反应。
(1)“操作I”中玻璃棒的作用是____________。“操作Ⅱ”时,当__________时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体。
(2)向“浸取液”中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为__________。
(3)“熔融煅烧”时,MnO2参与反应的化学方程式为_________________________。
(4)“歧化”时,加入冰醋酸的目的是___________________________(用必要的离子方程式和文字解释)。
(5)“歧化”时,下列酸可以用来代替冰醋酸的是___________(填字母)。
a.浓盐酸 b.亚硫酸 c.稀硫酸 d.氢碘酸
(6)制取过程中,若pH调节不合理易生成Mn2+。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含0.05mol·L-1Mn2+废水中通入一定量H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=__________。[已知:H2S的Ka1=1.3×10-7 Ka2=5.0×10-15;Ksp(MnS)=2.5×10-14]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)写出C元素基态原子的电子排布式:_________。
(2)用轨道表示式表示D元素原子的价电子构型:________。
(3)写出E离子的结构示意图:_________。
(4)元素B与D的电负性的大小关系:B________D,C与E的第一电离能的大小关系:C________E。(填>、<、=)
(5)由这五种元素组成的一种化合物是(写化学式)________。写出该物质的一种主要用途:________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com