
【题目】高锰酸钾消毒片主要成分为KMnO4,可外用消炎杀菌。用某软锰矿(主要成分是MnO2,还含有A12O3、SiO2等杂质)制备KMnO4的流程图如下:
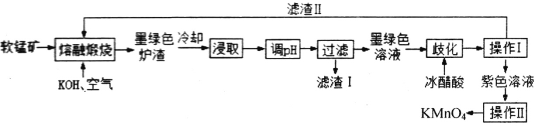
已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性且能发生可逆的歧化反应。
(1)“操作I”中玻璃棒的作用是____________。“操作Ⅱ”时,当__________时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体。
(2)向“浸取液”中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为__________。
(3)“熔融煅烧”时,MnO2参与反应的化学方程式为_________________________。
(4)“歧化”时,加入冰醋酸的目的是___________________________(用必要的离子方程式和文字解释)。
(5)“歧化”时,下列酸可以用来代替冰醋酸的是___________(填字母)。
a.浓盐酸 b.亚硫酸 c.稀硫酸 d.氢碘酸
(6)制取过程中,若pH调节不合理易生成Mn2+。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含0.05mol·L-1Mn2+废水中通入一定量H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=__________。[已知:H2S的Ka1=1.3×10-7 Ka2=5.0×10-15;Ksp(MnS)=2.5×10-14]
【答案】引流 表面出现晶膜 Al(OH)3和H2SiO3 2MnO2+4KOH+O2![]() 2K2MnO4+2H2O 调节溶液pH,使3MnO42-+2H2O
2K2MnO4+2H2O 调节溶液pH,使3MnO42-+2H2O ![]() 2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率 c 6
2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率 c 6
【解析】
软锰矿(主要成分为MnO2,还含有Al2O3、SiO2等杂质)与KOH在空气中熔融煅烧,主要的反应为:2MnO2+4KOH+O2![]() 2K2MnO4+2H2O,Al2O3、SiO2得到KAlO2和K2SiO3,冷却浸取,向浸取液中通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3,墨绿色溶液主要含有K2MnO4,加入冰醋酸歧化,促进平衡3MnO42++2H2O
2K2MnO4+2H2O,Al2O3、SiO2得到KAlO2和K2SiO3,冷却浸取,向浸取液中通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3,墨绿色溶液主要含有K2MnO4,加入冰醋酸歧化,促进平衡3MnO42++2H2O![]() 2MnO4-+MnO2↓+4OH-右移,过滤,滤渣II为MnO2,滤液为高锰酸钾溶液,结晶得到产品。
2MnO4-+MnO2↓+4OH-右移,过滤,滤渣II为MnO2,滤液为高锰酸钾溶液,结晶得到产品。
(1)操作I为过滤,玻璃棒起到引流作用,操作Ⅱ为结晶操作,“结晶”时,当表面出现晶膜时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体,
故答案为:引流;表面出现晶膜;
(2)通入CO2调节其pH,KAlO2和K2SiO3转化为Al(OH)3和H2SiO3,过滤,滤渣I主要为Al(OH)3和H2SiO3,
故答案为:Al(OH)3和H2SiO3;
(3)“熔融煅烧”时,MnO2参与反应的化学方程式为,被氧化生成高锰酸钾,方程式为2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O,
2K2MnO4+2H2O,
故答案为:2MnO2+4KOH+O2 ![]() 2K2MnO4+2H2O;
2K2MnO4+2H2O;
(4)“歧化”时,加入冰醋酸的目的是调节溶液pH,使3MnO42-+2H2O![]() 2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率,
2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率,
故答案为:调节溶液pH,使3MnO42-+2H2O![]() 2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率;
2MnO4-+MnO2↓+4OH-平衡向右移动,促进KMnO4的生成,提高KMnO4的产率;
(5)KMnO4具有强氧化性,不能用还原性酸,盐酸、亚硫酸以及氢碘酸均具有还原性,可以用稀硫酸替代醋酸,故答案为:c;
(6)向含Mn2+为0.005mol·L-1的废水中通入一定量的H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4 mol·L-1时,Mn2+开始沉淀,则c(Mn2+)c(S2-)=c(Mn2+)×![]() =Ksp(MnS),即0.005×
=Ksp(MnS),即0.005×![]() =2.5×10-15,解得c(H+)=1.0×10-6mol·L-1,即pH=6,
=2.5×10-15,解得c(H+)=1.0×10-6mol·L-1,即pH=6,
故答案为:6。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】关于如图所示的原电池,下列说法正确的是( )
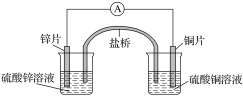
A. 电子从锌电极通过电流表流向铜电极
B. 盐桥中的阴离子向硫酸铜溶液中迁移
C. 锌电极发生氧化反应;铜电极发生还原反应,其电极反应是2H++2e-===H2↑
D. 取出盐桥后,电流表仍会偏转,铜电极在反应前后质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中正确的是
A.25 ℃时,0.1 mol·L-1 HF溶液中pH=1B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生D.该体系中,Ksp(CaF2)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是(已知质子交换膜的作用是只允许H+通过)( )
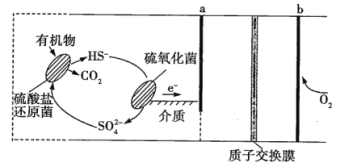
A.该电池在高温下工作的速度更快
B.HS-在硫氧化菌作用下转化为SO42-的电极反应式为HS-+4H2O-8e-=SO42-+9H+
C.b电极是电池的负极
D.该电池工作时,H+向左通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1887年,英国人赫勒森发明了最早的干电池,如今干电池已经发展成为一个庞大的家族,种类达100多种。应用广泛的是Zn—MnO2干电池,其电解质溶液是ZnCl2—NH4Cl混合溶液。电池工作一段时间后,电池内存在7种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O。请回答下列问题
(1)该电池的负极材料是__;电池工作时,电子流向__(填“正极”或“负极”,下同);放电时NH4+向___移动。
(2)该氧化还原反应的化学方程式为__,发生还原反应的物质是__,被氧化的元素是__。若有17.4g氧化剂参与反应,则电子转移数目为__NA(NA表示阿伏加德罗常数的值)。
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是___。
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__。欲除去Cu2+,最好选用下列试剂中的__(填序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组为了探究葡萄糖的结构与性质,在实验室中分别取18g葡萄糖进行下列几个实验。试回答下列问题:
(1)发生银镜反应时,消耗_____mol[Ag(NH3)2]OH,反应后葡萄糖变为一种盐,其结构简式是___。
(2)与乙酸反应生成酯,若一定条件下乙酸的转化率为60%,那么这些葡萄糖发生酯化反应消耗的乙酸为___________g。
(3)若使之完全转化为CO2和H2O,所需氧气的体积为__________L(标准状况下),反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】杂志Joule中题为“Li—CO2 Electrochemistry:A New Strategy for CO2 Fixation and Energy Storage”的文章,阐述关于电化学技术固定CO2新的反应途径。下图是采用新能源储能器件将CO2转化为固体产物,实现CO2的固定和储能灵活应用的装置。储能器件使用的Li—CO2电池组成为钌电极/CO2—饱和LiClO4—DMSO电解液/锂片。下列说法错误的是
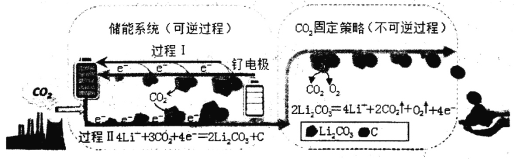
A.钌电极为负极,其电极反应式为:2Li2CO3+C—4e-=== 3CO2+4Li+
B.Li—CO2电池电解液由LiClO4—DMSO溶于水得到
C.这种电化学转化方式不仅减少CO2的排放,还可将CO2作为可再生能源载体
D.CO2的固定中,每生成1.5mol气体,可转移2mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药用有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图所示的一系列反应。则下列说法正确的是
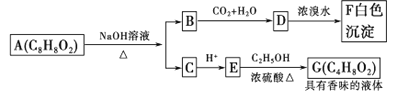
A.A的结构简式为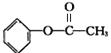
B.根据D和浓溴水反应生成白色沉淀可推知D为三溴苯酚
C.G的同分异构体中属于酯,且能发生银镜反应的只有一种
D.图中B→F与C→G发生反应的类型不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com