
【题目】某化学学习小组为了探究葡萄糖的结构与性质,在实验室中分别取18g葡萄糖进行下列几个实验。试回答下列问题:
(1)发生银镜反应时,消耗_____mol[Ag(NH3)2]OH,反应后葡萄糖变为一种盐,其结构简式是___。
(2)与乙酸反应生成酯,若一定条件下乙酸的转化率为60%,那么这些葡萄糖发生酯化反应消耗的乙酸为___________g。
(3)若使之完全转化为CO2和H2O,所需氧气的体积为__________L(标准状况下),反应的化学方程式是______。
【答案】0.2 CH2OH(CHOH)4COONH4 18 13.44 CH2OH(CHOH)4CHO+6O2![]() 6CO2+H2O
6CO2+H2O
【解析】
(1)![]() ,葡萄糖与银氨溶液反应的化学方程式为CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH
,葡萄糖与银氨溶液反应的化学方程式为CH2OH(CHOH)4CHO+2[Ag(NH3)2]OH![]() CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O,故0.1mol葡萄糖消耗0.2mol[Ag(NH3)2]OH,该盐为CH2OH(CHOH)4COONH4;
CH2OH(CHOH)4COONH4+2Ag↓+3NH3+H2O,故0.1mol葡萄糖消耗0.2mol[Ag(NH3)2]OH,该盐为CH2OH(CHOH)4COONH4;
(2)0.1mol葡萄糖含0.5mol羟基,所以需要0.5mol乙酸进行反应,乙酸的转化率为60%,故酯化反应消耗的乙酸为0.5mol×60g/mol×60%=18g;
(3)葡萄糖完全燃烧的化学方程式为CH2OH(CHOH)4CHO +6O2![]() 6CO2+6H2O,0.1mol葡萄糖消耗的O2为0.6mol,标准状况下的体积为0.6mol×22.4L/mol=13.44L。
6CO2+6H2O,0.1mol葡萄糖消耗的O2为0.6mol,标准状况下的体积为0.6mol×22.4L/mol=13.44L。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列关于铁的腐蚀和防护的叙述正确的是( )
A.用铁锅烧制糖醋鱼时,铁锅会发生化学腐蚀和析氢腐蚀
B.铁发生吸氧腐蚀的负极反应可用O2+4e-+2H2O=4OH-表示
C.常温下,铁在浓硫酸中比在稀硫酸中腐蚀得快
D.可用如图表示对钢铁采取外加电流的阴极保护法的原理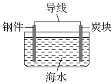
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 NH4Cl、盐酸、NaClO2 为原料制备 ClO2 的过程如下图所示,下列说法不正确的是
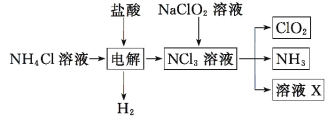
A.X 中大量存在的阴离子有 Cl-和 OH-B.NCl3 的键角比 CH4 的键角大
C.NaClO2 变成 ClO2 发生了氧化反应D.制取 3 mol ClO2 至少需要 0.5mol NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池方面获得新突破,研制出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。(已知:质子交换膜的作用是只允许H+通过;甲醇在氧气中燃烧生成CO2和H2O。)

(1)该电池工作时,b处通入的物质为__,c处通入的物质为___。
(2)该电池负极的电极反应式为__。
(3)该电池工作一段时间后,当12.8g甲醇完全反应时,有___mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾消毒片主要成分为KMnO4,可外用消炎杀菌。用某软锰矿(主要成分是MnO2,还含有A12O3、SiO2等杂质)制备KMnO4的流程图如下:
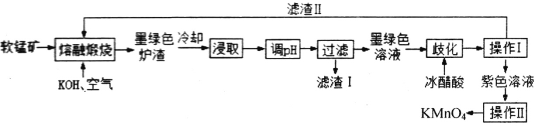
已知:K2MnO4固体和溶液均为墨绿色,溶液呈碱性且能发生可逆的歧化反应。
(1)“操作I”中玻璃棒的作用是____________。“操作Ⅱ”时,当__________时,停止加热,自然冷却,抽滤后即可获得紫黑色KMnO4晶体。
(2)向“浸取液”中通入CO2,调节其pH,经“过滤”得滤渣I,滤渣I的成分为__________。
(3)“熔融煅烧”时,MnO2参与反应的化学方程式为_________________________。
(4)“歧化”时,加入冰醋酸的目的是___________________________(用必要的离子方程式和文字解释)。
(5)“歧化”时,下列酸可以用来代替冰醋酸的是___________(填字母)。
a.浓盐酸 b.亚硫酸 c.稀硫酸 d.氢碘酸
(6)制取过程中,若pH调节不合理易生成Mn2+。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含0.05mol·L-1Mn2+废水中通入一定量H2S气体,调节溶液的pH=a,当HS-浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=__________。[已知:H2S的Ka1=1.3×10-7 Ka2=5.0×10-15;Ksp(MnS)=2.5×10-14]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是___________。
(2)C的燃烧热为_________________。
(3)燃烧10g H2生成液态水,放出的热量为_________________。
(4)CO燃烧的热化学方程式为 ________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质与NaOH醇溶液共热完全反应后,可得3种有机物的是( )
A.CH3﹣CHCl﹣CH2﹣CH3
B.
C.CH3﹣C(CH3)Cl﹣CH2﹣CH3
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某厂废水中含KCN,其浓度为0.01 mol·L-1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):
KCN+2KOH+Cl2===KOCN+2KCl+H2O
(1)上述反应中被氧化的元素是________(用元素符号表示)。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:______________
______KOCN+______Cl2+______![]() ===______K2CO3+______N2+______KCl+______
===______K2CO3+______N2+______KCl+______![]()
(3)若将10 L含KCN的浓度为0.01 mol·L-1的废水中KCN氧化除去,最少需要氯气________ mol。
Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。
(4)现实验室需用480 mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需________。
(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO![]() ,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为_________________。
,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面均是正丁烷与氧气反应的热化学方程式(25℃、101kPa):
①C4H10(g)+![]() O2(g)═ 4CO2(g)+5H2O(l);△H=-2 878kJ/mol
O2(g)═ 4CO2(g)+5H2O(l);△H=-2 878kJ/mol
②C4H10(g)+![]() O2(g)═ 4CO2(g)+5H2O(g);△H=-2 658kJ/mol
O2(g)═ 4CO2(g)+5H2O(g);△H=-2 658kJ/mol
③C4H10(g)+![]() O2(g)═ 4CO(g)+5H2O(l);△H=-1 746kJ/mol
O2(g)═ 4CO(g)+5H2O(l);△H=-1 746kJ/mol
④C4H10(g)+![]() O2(g)═ 4CO(g)+5H2O(g);△H=-1 526kJ/mol
O2(g)═ 4CO(g)+5H2O(g);△H=-1 526kJ/mol
由此判断,正丁烷的燃烧热为( )
A.2878kJ/molB.2658kJ/molC.1746kJ/molD.1526kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com