
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是___________。
(2)C的燃烧热为_________________。
(3)燃烧10g H2生成液态水,放出的热量为_________________。
(4)CO燃烧的热化学方程式为 ________________________________________。
【答案】①②③④ 393.5 kJ/mol 1425 kJ CO(g)+![]() O2(g)=CO2(g) ΔH=-283.1kJ/mol
O2(g)=CO2(g) ΔH=-283.1kJ/mol
【解析】
(1)热化学方程式中ΔH为负值的反应为放热反应,ΔH为正值的反应为吸热反应,题中所给4个反应均为放热反应。
答案为:①②③④。
(2)101kPa,1mol可燃物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,根据④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ/mol可知,C的燃烧热为393.5 kJ/mol。
答案为:393.5 kJ/mol。
(3)依据反应①进行计算燃烧10gH2生成液态水放出的热量:
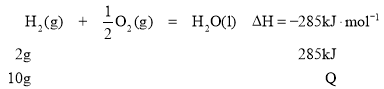
Q=![]() 。
。
答案为:1425kJ。
(4)根据盖斯定律,用题中所给反应④-③得到:CO(g)+![]() O2(g)=CO2(g) ΔH=-283.1kJ/mol。
O2(g)=CO2(g) ΔH=-283.1kJ/mol。
答案为:CO(g)+![]() O2(g)=CO2(g) ΔH=-283.1kJ/mol。
O2(g)=CO2(g) ΔH=-283.1kJ/mol。


科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。
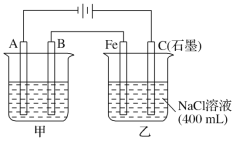
试回答下列问题:
(1)A是________极,材料是________,电极反应为_____________,B是________极,材料是________,主要电极反应为_________________,电解质溶液为________。
(2)乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈________色。
(3)常温下,若甲池中阴极增重12.8 g,则乙池中阳极放出的气体在标准状况下的体积为________。若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________,pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( )
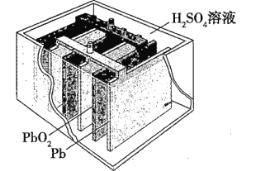
A.PbO2是电池的负极
B.Pb是电池的负极
C.PbO2得电子,被氧化
D.电池放电时,溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是一种重要的化工产品。常温时是一种有毒并有恶臭的金黄色液体,熔点-76℃,沸点138℃,受热或遇水分解放热,放出腐蚀性烟气,易与水反应,300℃以上完全分解。进一步氯化可得 SCl2, SCl2 是樱桃红色液体,易挥发,熔点-122℃,沸点 59℃。SCl2与 S2Cl2 相似,有毒并有恶臭,但更不稳 定。实验室可利用硫与少量氯气在 110~140℃反应制得 S2Cl2 粗品。
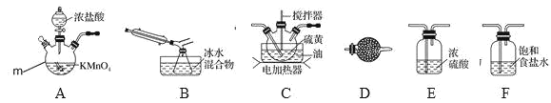
请回答下列问题:
(1)仪器 m 的名称为______,装置 D 中试剂的作用是______。
(2)装置连接顺序:______→B→D。
(3)为了提高 S2Cl2 的纯度,实验的关键是控制好温度和______。
(4)从 B 中分离得到纯净的 S2Cl2,需要进行的操作是______;
(5)若将S2Cl2放入少量水中会同时产生沉淀和两种气体。某同学设计了如下实验方案,测定所得混合气体中某一成分 X 的体积分数:
![]()
①W 溶液可以是______(填标号)。
a H2O2 溶液 b 氯水 c 酸性 KMnO4 溶液 d FeCl3 溶液
②该混合气体中气体 X 的体积分数为______(用含 V、m 的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组为了探究葡萄糖的结构与性质,在实验室中分别取18g葡萄糖进行下列几个实验。试回答下列问题:
(1)发生银镜反应时,消耗_____mol[Ag(NH3)2]OH,反应后葡萄糖变为一种盐,其结构简式是___。
(2)与乙酸反应生成酯,若一定条件下乙酸的转化率为60%,那么这些葡萄糖发生酯化反应消耗的乙酸为___________g。
(3)若使之完全转化为CO2和H2O,所需氧气的体积为__________L(标准状况下),反应的化学方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯是重要的化工原料。其实验室制备流程如下:
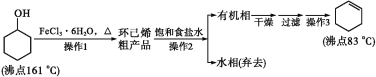
回答下列问题:
Ⅰ.环己烯的制备与提纯
(1)原料环己醇中若含苯酚杂质,检验试剂为__________,现象为____________。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
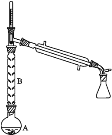
①烧瓶A中进行的可逆反应化学方程式为__________________________________,浓硫酸也可作该反应的催化剂,选择FeCl3·6H2O而不用浓硫酸的原因为___________(填序号)。
a.浓硫酸易使原料炭化并产生SO2
b.FeCl3·6H2O污染小、可循环使用,符合绿色化学理念
c.同等条件下,用FeCl3·6H2O比浓硫酸的平衡转化率高
②仪器B的作用为____________________________。
(3)操作2用到的玻璃仪器是__________________________。
Ⅱ.环己烯含量的测定
在一定条件下,向a g环己烯样品中加入定量制得的b mol Br2,与环己烯充分反应后,剩余的Br2与足量KI作用生成I2,用c mol·L-1的Na2S2O3标准溶液滴定,终点时消耗Na2S2O3标准溶液V mL(以上数据均已扣除干扰因素)。
测定过程中,发生的反应如下:
①Br2+![]() →
→![]()
②Br2+2KI=I2+2KBr
③I2+2Na2S2O3=2NaI+Na2S4O6
(4)滴定所用指示剂为__________________________。样品中环己烯的质量分数为______________________(用字母表示)。
(5)下列情况会导致测定结果偏低的是__________________(填序号)。
a.样品中含有苯酚杂质
b.在测定过程中部分环己烯挥发
c.Na2S2O3标准溶液部分被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):2CHCl3+O2―→2HCl +2COCl2。下列说法不正确的有

A. CHCl3分子的空间构型为正四面体
B. COCl2分子中中心C原子采用sp2杂化
C. COCl2分子中所有原子的最外层电子都满足8电子稳定结构
D. 使用前可用硝酸银稀溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下反应C(s)+CO2 (g)2CO(g)不能自发进行,则该反应△H>0
B.自发反应的熵一定增大,非自发反应的熵一定减小
C.凡是放热反应都是自发的,凡是吸热反应都是非自发的
D.反应2Mg(s)+CO2 (g)C(s)+2MgO(s)能自发进行,则该反应△H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com