
【题目】如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。
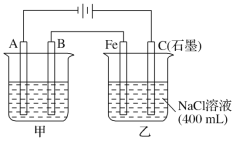
试回答下列问题:
(1)A是________极,材料是________,电极反应为_____________,B是________极,材料是________,主要电极反应为_________________,电解质溶液为________。
(2)乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈________色。
(3)常温下,若甲池中阴极增重12.8 g,则乙池中阳极放出的气体在标准状况下的体积为________。若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________,pH为________。
【答案】阴 纯铜 Cu2++2e-===Cu 阳 粗铜 Cu-2e-===Cu2+ CuSO4溶液(其他合理答案也可) 红 4.48 L 1.0 mol/L 14
【解析】
(1)依据电解精炼铜的原理是粗铜做阳极,精铜做阴极,含铜离子的电解质溶液进行电解反应,据此分析解答;
(2)依据装置图,与电源正极相连的石墨电极为电解池的阳极,与电源负极连的Fe为阴极,据此分析解答;
(3)依据电极反应和电子守恒计算甲池和乙池中电极产物的物质的量,乙池中依据氢离子和氢氧根离子守恒,水的离子积常数计算得到c(OH-)和pH。
(1)电解精炼铜的原理为:粗铜做阳极,精铜做阴极,含铜离子的电解质溶液(如CuSO4溶液)进行电解反应,在阴极是溶液中铜离子得到电子生成铜,电极反应是Cu2++2e-═Cu,在阳极上Cu失去电子生成铜离子,电极反应是Cu-2e-═Cu2+,故答案为:阴;精铜(或纯铜); Cu2++2e-=Cu;阳;粗铜;Cu-2e-═Cu2+;CuSO4溶液;
(2)依据装置图分析可知,与电源正极相连的石墨电极为电解池的阳极,与电源负极连接的铁电极是阴极,Fe电极上是溶液中氢离子得到电子生成氢气,电极反应为2H++2e-═H2↑,破坏水的电离平衡,氢氧根离子浓度增大,铁电极附近滴入少量酚酞溶液,溶液变红色,故答案为:红;
③甲池中A为电解池的阴极,电极反应为Cu2++2e-═Cu,12.8g铜的物质的量为0.2mol,增重12.8 g铜转移0.4mol电子;乙池C(石墨)极为电解池的阳极,电极反应为:2Cl--2e-═Cl2↑,依据得失电子守恒,生成氯气0.2mol,放出的氯气在标况下的体积为0.2mol×22.4L/mol=4.48L,Fe电极电解反应为:2H++2e-═H2↑,消耗氢离子物质的量0.4mol,依据水的电离氢离子和氢氧根离子守恒得到,生成氢氧根离子的c(OH-)=![]() =1mol/L,溶液pH=14,故答案为:4.48L;1mol/L;14。
=1mol/L,溶液pH=14,故答案为:4.48L;1mol/L;14。


科目:高中化学 来源: 题型:
【题目】(1)①为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。Fe在元素周期表中的位置为__________。科学家在研究金属矿物质组分的过程中。发现了Cu-Ni-Fe等多种金属互化物。确定某种金属互化物是晶体还是非晶体的方法是_____________。
②已知:r(Fe2+)为61 pm,r(Co2+)为65 pm。在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3的分解温度低于CoCO3,原因是_______。
③下表是Fe和Cu的部分电离能数据,请解释I2(Cu)大于I2(Fe)的主要原因是_____。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第一电离能I2/kJ·mol-1 | 1561 | 1958 |
(2)原子序数依次增大的五种元素A、B、C、D、E分别处于第一至第四周期,A是前四周期中原子半径最小的元素,B原子核外电子有6种不同的运动状态,常温下C的单质是空气中含量最多的成份,D最高价氧化物对应水化物的酸性最强,E的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
①B2A2的电子式是___,D所在主族的前四种元素分别与A形成的化合物,其共价键的极性由强到弱的顺序是___(填化学式)。
②A和C形成的简单化合物遇到D单质出现白烟现象,写出有关反应的化学方程式为____。
③向E的硫酸盐溶液中滴加过量氨水,观察到的现象是首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液,请写出最后-步得到深蓝色透明溶液对应的离子方程式____。
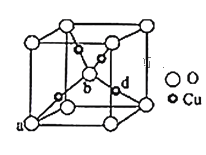
(3)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。
),则d的坐标参数为__,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数(晶胞棱长)为_______cm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前合成纤维中产量占第一位的是聚酯纤维——涤纶,下面是合成涤纶的流程图。
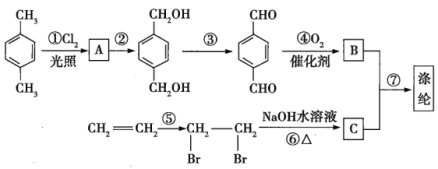
回答下列问题:
(1)写出中间产物的结构简式:![]() _______,
_______,![]() __________,
__________,![]() _______。
_______。
(2)写出下列反应所需的试剂:②_____________,⑤______________。
(3)合成过程的七步反应中,属于氧化反应的有_____(填序号,下同),属于加成反应的有______。
(4)写出反应⑦的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
(1)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2 g。则10min内CO的平均反应速率为________。
(2)请用上述反应中某种气体的有关物质理量来说明该反应已达到平衡状态:
①____________________________________________________;
②____________________________________________________。
(3)写出氢氧化铝在水中发生碱式电离的电离方程式:________________;欲使上述体系中铝离子浓度增加,可加入的物质是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铁的腐蚀和防护的叙述正确的是( )
A.用铁锅烧制糖醋鱼时,铁锅会发生化学腐蚀和析氢腐蚀
B.铁发生吸氧腐蚀的负极反应可用O2+4e-+2H2O=4OH-表示
C.常温下,铁在浓硫酸中比在稀硫酸中腐蚀得快
D.可用如图表示对钢铁采取外加电流的阴极保护法的原理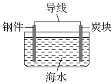
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比 pH 的定义,对于稀溶液可以定义pC(X)=-lg c(X),pKa=-lg Ka,常温下,某浓度 H2A 溶液在不同 pH 下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
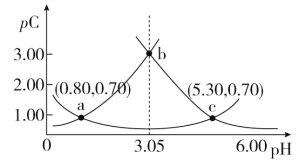
A.随着 pH 的增大,pC 增大的曲线是 A2-的物质的量浓度的负对数
B.pH=3.50 时,c(HA-)>c(A2-)>c(H2A)
C.b 点时, =104.50
=104.50
D.pH=3.00~5.30 时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢原子是最轻的原子,人们曾预言它可能是所有元素之母。碳是地球上组成生命的最基本的 元素之一。按要求回答:
(1)宇宙中含量最多的元素是氢和______。基态碳原子的核外电子占有______个原子轨道。
(2)光化学烟雾中除了含有 NOx 外,还含有 HCOOH、![]() (PAN)等二次污染物。
(PAN)等二次污染物。
①PAN 中 C 的杂化方式有______。1mol PAN 中含有的σ键数目为______。组成PAN 的元素的电负性大小顺序为______。
②相同压强下,HCOOH 的沸点比 CH3OCH3______(填“高”或“低”),
(3)水溶液中有 H3O+、H5O2+ 、H9O4 + 等微粒的形式。请画出 H5O2 的结构式:______。
(4)硅和碳在同一主族。下图为 SiO2 晶胞中 Si 原子沿 z 轴方向在 xy 平面的投影图(即俯视图),其 中 O原子略去,Si 原子旁标注的数字表示每个 Si 原子位于 z 轴的高度,则 SiA 与 SiB 之间的距离是______nm。
 (d 的单位为 nm)
(d 的单位为 nm)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由 W、X、Y、Z 四种短周期元素组成,其中 W、Y、Z 分别位于三个不同周期,Y 核外最外层电子数是 W 核外最外层电子数的二倍;W、X、Y 三种简单离子的核外电子排布相同。下列说法不正确的是
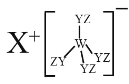
A.原子半径:W < X < Y < Z
B.X 与 Y、Y 与 Z 均可形成具有漂白性的化合物
C.简单离子的氧化性: W X
D.W 与 X 的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285kJ/mol
O2(g)=H2O(l) ΔH=-285kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol
O2(g)=H2O(g) ΔH=-241.8kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.4 kJ/mol
O2(g)=CO(g) ΔH=-110.4 kJ/mol
④C(s)+ O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是___________。
(2)C的燃烧热为_________________。
(3)燃烧10g H2生成液态水,放出的热量为_________________。
(4)CO燃烧的热化学方程式为 ________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com