
【题目】类比 pH 的定义,对于稀溶液可以定义pC(X)=-lg c(X),pKa=-lg Ka,常温下,某浓度 H2A 溶液在不同 pH 下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
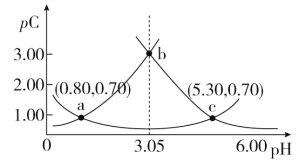
A.随着 pH 的增大,pC 增大的曲线是 A2-的物质的量浓度的负对数
B.pH=3.50 时,c(HA-)>c(A2-)>c(H2A)
C.b 点时, =104.50
=104.50
D.pH=3.00~5.30 时,c(H2A)+c(HA-)+c(A2-)先减小后增大
【答案】BC
【解析】
H2A存在电离平衡:H2A![]() H++HA-、HA-
H++HA-、HA-![]() H++A2-,pH增加促进电离平衡正向移动,所以由图可知:下方曲线是HA-的物质的量浓度的负对数,左侧曲线是H2A的物质的量浓度的负对数,右侧曲线是A2-的物质的量浓度的负对数,由此分析解答。
H++A2-,pH增加促进电离平衡正向移动,所以由图可知:下方曲线是HA-的物质的量浓度的负对数,左侧曲线是H2A的物质的量浓度的负对数,右侧曲线是A2-的物质的量浓度的负对数,由此分析解答。
A.由分析可知,随着pH的增大,pC增大的曲线是H2A的物质的量浓度的负对数,故A错误;
B.pH=3.50时,左侧曲线是H2A的物质的量浓度的负对数,右侧曲线是A2-的物质的量浓度的负对数,此时pC(H2A)>pC(A2-)>pC(HA-),即c(HA-)>c(A2-)>c(H2A),故B正确;
C.b点时,c(H2A)=c(A2-),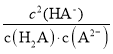 =
=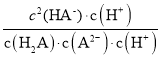 =Ka1/Ka2=10-0.8/10-5.3=104.5,故C正确;
=Ka1/Ka2=10-0.8/10-5.3=104.5,故C正确;
D.pH=3.00~5.30时,结合物料守恒c(H2A)+c(HA-)+c(A2-)始终不变,故D错误;
故答案选BC。


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】某种钠空气水电池的充、放电过程原理示意图如图所示,下列有关说法错误的是
■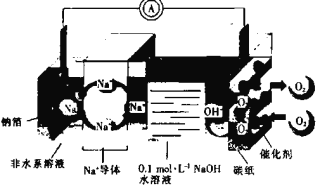
A.放电时,Na+向正极移动
B.放电时,电子由钠箔经过导线流向碳纸
C.充电时,当有0.1mole-通过导线时,则钠箔增重2.3g
D.充电时,碳纸与电源负极相连,电极反应式为4OH--4e=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如图所示的装置,当电流表中产生持续电流时,下列说法正确的是( )
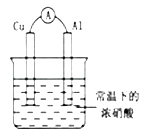
A.Cu是原电池的负极
B.Al是原电池的负极
C.电子由Al沿导线流向铜
D.铝片上的电极反应式为:Al﹣3e﹣═AL3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中常用MnS作为沉淀剂除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)![]() CuS(s)+Mn2+(aq),下列说法正确的是
CuS(s)+Mn2+(aq),下列说法正确的是
A.该反应达到平衡时,c(Mn2+)=c(Cu2+)
B.该反应达到平衡时,Ksp(CuS)较大
C.往平衡体系中加入少量CuSO4固体后,c(Mn2+)减小
D.该反应的平衡常数K=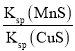
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲、乙两电解池,其中甲池为电解精炼铜的装置。
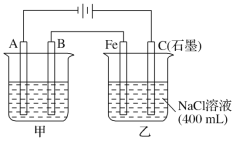
试回答下列问题:
(1)A是________极,材料是________,电极反应为_____________,B是________极,材料是________,主要电极反应为_________________,电解质溶液为________。
(2)乙池中若滴入少量酚酞溶液,电解一段时间后Fe极附近溶液呈________色。
(3)常温下,若甲池中阴极增重12.8 g,则乙池中阳极放出的气体在标准状况下的体积为________。若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为________,pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)结构简式为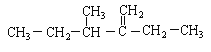 此烃名称为_______________。
此烃名称为_______________。
(2)某烷烃被命名为3,5-二甲基-2—乙基己烷,该名称不正确,正确的命名为________________。
(3)在实验室鉴定1-氯丙烷中氯元素的操作步骤是____________(填序号)。
①滴加AgNO3溶液;②加NaOH溶液;③加热;④用HNO3酸化;
(4)乙基香草醛(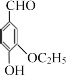 )是食品添加剂的增香原料,其香味比香草醛更加浓郁。写出乙基香草醛分子中官能团称___________、___________、___________。
)是食品添加剂的增香原料,其香味比香草醛更加浓郁。写出乙基香草醛分子中官能团称___________、___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点

(1)在100℃时,Kw表达式为_______,在此温度下,kw为___.
(2)在室温下,将pH=9的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7则Ba(OH)2与盐酸的体积比为____.
(3)室温时将PH为3的硫酸溶液稀释100倍,稀释后溶液中,C(SO42-)和C(H+)之比约为___.
II.今有①CH3COOH ②HCl ③H2SO4三种溶液.根据要求回答下列问题:
(1)写出①的电离方程式_______.
(2)当它们pH相同时,其物质的量浓度最大的是___(填序号).
(3)当它们的物质的量浓度相同时,其pH最小是___(填序号).
(4)在室温下,将c(H+)均为0.01mol/L的三种酸分别加水稀释至原来的10倍,c(H+)由大到小的顺序为___(填序号).
(5)体积和物质的量浓度均相同的①②③三种酸溶液,分别与相同浓度的烧碱溶液恰好完全反应,所需烧碱的体积比为____.
(6)三酸的pH相同时,若耗等量的Zn,则需三酸的体积大小关系为___(填序号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列转化过程分析不正确的是
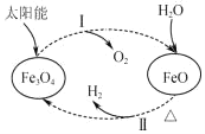
A.Fe3O4 中 Fe 元素的化合价为+2、+3
B.过程Ⅰ中每消耗 58 g Fe3O4 转移 1 mol 电子
C.过程Ⅱ的化学方程式为 3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为 2H2O═2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com