
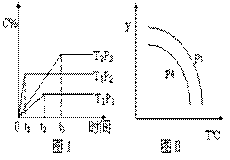
在一密闭体系中发生下列反应A(g)+3B(g)  2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是:
__________、__________、__________;
(2)C体积分数最高的时间段是__________。(填“tx-ty”)
【知识点】平衡的移动

【答案解析】(1)升温、使用正催化剂、减压(各1分);
(2)t0-t1(2分)
解析:(1)t1时刻正逆速率都增加,平衡逆向移动,改变的条件是升温;t3时刻正逆速率同等程度增加,平衡不移动,改变的条件是使用正催化剂;t4时刻正逆速率都减小,平衡逆向移动,改变的条件是减压。(2)平衡两次逆向移动,所以C体积分数最高的时间段是第一次平衡时,即t0-t1。
【思路点拨】本题考查平衡移动,关键是看懂图象,知识考查很基础。
 27.(5分)在某容积可变的密闭容器中,有下列的可逆反应:A(g) + B(g)
27.(5分)在某容积可变的密闭容器中,有下列的可逆反应:A(g) + B(g) 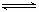 xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线。试判断对图2的说法中正确的是
xC(g),有图1(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线。试判断对图2的说法中正确的是
A.P3>P4,y轴表示C的体积分数
B.P3<P4,y轴表示B的质量分数
C.P3<P4,y轴表示混合气体的密度
D.P3>P4,y轴表示混合气体的平均摩尔质量
【知识点】温度、压强对平衡的影响
【答案解析】A,D
解析:依据图(Ⅰ)知,p2>p1,加压C的体积分数升高,即加压平衡右移,故x=1;T1>T2,可见升温C的体积分数降低,即升温平衡左移,故正反应为放热反应.即该反应为:A(g)+B(g)  C(g)(正反应为放热反应).
C(g)(正反应为放热反应).
由图(Ⅱ)知:随着温度升高y降低,结合方程式特点依次分析四个选项即可得到A,D正确。
【思路点拨】本题考查温度、压强对平衡的影响,图象包含的内容多,难度较大,一定要细心谨慎,为易错题。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30 mL,加入同一种镁铝合金粉末,产生气体,有关数据列表如下(气体体积在标准状况下测定):
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 气体体积/mL | 280 | 336 | 336 |
(1)乙组实验中,盐酸________(填“过量”“适量”或“不足量”),理由是________________。
(2)要计算盐酸的物质的量浓度,题中可作计算依据的数据是________。
(3)要计算合金中Mg、Al的物质的量之比,题中可作计算依据的数据是________,Mg、Al的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A为含金属离子的淡黄色固体化台物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如下图(部分产物已略去)。
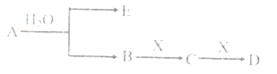
请回答下列问题
(1)这种金属离子的离子结构示意图为_____________;
(2)X的电子式_______________;
(3)B中所含化学键的类型是_____________;
常温常压下,7.8gA与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式
_________________________________________________________________.
(4)①C也可转化为B,写出该转化的化学方程式_______________________________;
②B与D反应的离子方程式为_______________________________________.
(5)将一定量的气体X通入2LB的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图(忽略气体的溶解和HCl的挥发)。

请回答:a点溶液中所含溶质的化学式为__________ ,a-b之间的反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关热化学方程式的叙述正确的是
A.2H2(g)+O2(g)===2H2O(g);△H=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
B.已知C(石墨,s)=== C(金刚石,s) △H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该反应的热化学方程式为:NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l);△H=-57.4 kJ/mol
D.已知2C(s)+2O2(g)==2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g) △H2。则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应: 2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为:
(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应转化关系(未配平)肯定不正确的是
A.Cu2O+H2SO4→CuSO4+Cu+H2O
B.FeO+HNO3→Fe(NO3)3+H2O
C.NH4NO3→N2 O +H2O
D.S+KOH→K2SO3+K2S+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是
A.HNO3是氧化剂,NO2是氧化产物
B.若2mol HNO3(浓)完全反应,则反应中共转移了NA个电子
C.还原剂与氧化剂的物质的量比是1 :4
D.氧化产物和还原产物的物质的量之比为2 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )。
A.所有的不锈钢都只含有金属元素
B.我国流通的硬币材质是金属单质
C.广东打捞出的明代沉船上存在大量铝制餐具
D.镁合金的硬度和强度均高于纯镁
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) ▲0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= ▲ mol·L-1,c (H+) − c (MOH) = ▲ mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 ▲ (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 ▲ 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH ▲ 7(填“>、<或=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com