
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) ▲0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= ▲ mol·L-1,c (H+) − c (MOH) = ▲ mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 ▲ (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 ▲ 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH ▲ 7(填“>、<或=”)。
【知识点】酸碱混合时的定性判断及有关pH的计算.
【答案解析】(1)> (2) 9.9×10-7; 10-8 (3)< c(Cl-)>c(M+)>c(H+)>c(OH-) (4)>
解析::(1)等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,而酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol•L-1 HCl溶液中水电离出的c(H+),
(2)根据电荷守恒得c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol•L-1,根据质子守恒得 c(H+)-c(MOH)=c(OH-)=1.0×10-8mol•L-1,
(3)室温下如果取0.2mol•L-1 MOH溶液与0.1mol•L-1 HCl溶液等体积混合,溶液中的溶质是MCl和MOH,测得混合溶液的pH<7,说明碱的电离程度小于盐的水解程度,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒知c(Cl-)>c(M+),盐中阴阳离子浓度大于氢离子和氢氧根离子浓度,所以溶液中各离子浓度由大到小的顺序为c(Cl-)>c(M+)>c(H+)>c(OH-),
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,氨水的浓度大于0.001mol/L,而盐酸的浓度为0.001mol/L,等体积混合后氨水过量,溶液显示碱性,溶液的pH>7,
【思路点拨】本题考查酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,根据电荷守恒和质子守恒分析弱电解质的电离及盐类水解,题目难度中等.


科目:高中化学 来源: 题型:
在一密闭体系中发生下列反应A(g)+3B(g)  2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
2C(g) △H<0,下图是某一时间段中反应速率与反应进程的曲线关系,完成下列问题:
(1)t1、t3、t4时刻体系中所改变的条件可能是:
__________、__________、__________;
(2)C体积分数最高的时间段是__________。(填“tx-ty”)
【知识点】平衡的移动

查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是( )
A.N点时溶液中的溶质只有NaCl
B.原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C.c (NaOH)=c (HCl)
D.M点之前加入的是NaOH溶液,M点之后加入的是盐酸
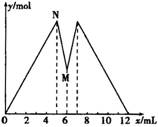
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA 为阿伏加德罗常数的值。下列说法正确的是
A.1 L 0.1mol•L-1的氨水含有0.1NA个OH-
B.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
C.25℃时,pH =13的Ba(OH)2溶液中含有OH-的数目为0 .1 NA
D.在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
将6 mol A和5 mol B混合于4 L恒容密闭容器中,发生如下反应:3A(g)+B(g)  nC(g)+2D(g)
nC(g)+2D(g)
5 s后反应达到平衡状态,生成2 mol D,经测定以C表示的平均反应速率为0.1 mol·L-1·s-1。则下列结论中正确的是
A.5 s内以A表示的平均反应速率为0.15 mol·L-1·s-1
B.平衡时,B的浓度为1 mol·L-1
C.n值等于1
D.平衡时B的转化率为50%
查看答案和解析>>
科目:高中化学 来源: 题型:
现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+ B.苹果汁含有Cu2+
C.苹果汁含有OH- D.苹果汁含有Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
向硫酸亚铁、硫酸铁、硫酸铜的混合溶液中加入铁粉,充分反应后过滤,滤渣中有铜粉和少量铁粉。那么此时的溶液中( )
A.肯定有Fe2+,可能有Fe3+ B.肯定有Fe3+,可能有Cu2+
C.肯定有Fe2+,可能有Fe3+和Cu2+ D.只有Fe2+,没有Fe3+和Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×lO5 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是
A. H2O(g)=H2(g)+ 1/2O2 (g)△H=+242 kJ.mol-1 B. 2H2(g)+O2(g)=2H2O(l) △H= -484 kJ.mol-l
C. H2(g)+ 1/2O2(g)=H2O(g) △H=+242 kJ.mol-l D. 2H2(g) + O2(g) = 2 H2O(g) △H= -484 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
给定一定物质的量的理想气体,影响其所占体积大小的主要因素是 ( )
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com