
向硫酸亚铁、硫酸铁、硫酸铜的混合溶液中加入铁粉,充分反应后过滤,滤渣中有铜粉和少量铁粉。那么此时的溶液中( )
A.肯定有Fe2+,可能有Fe3+ B.肯定有Fe3+,可能有Cu2+
C.肯定有Fe2+,可能有Fe3+和Cu2+ D.只有Fe2+,没有Fe3+和Cu2+
科目:高中化学 来源: 题型:
反应4HNO3(浓)+Cu=Cu(NO3)2+2NO2↑+2H2O,下列说法正确的是
A.HNO3是氧化剂,NO2是氧化产物
B.若2mol HNO3(浓)完全反应,则反应中共转移了NA个电子
C.还原剂与氧化剂的物质的量比是1 :4
D.氧化产物和还原产物的物质的量之比为2 :1
查看答案和解析>>
科目:高中化学 来源: 题型:
A~J分别表示中学化学中常见的物质,它们之间的相互转化关系如图所示(部分反应物、生成物没有列出)。已知:G为金属元素的固态氧化物(常温下);A、B、C、D、E、F六种物质中均含有同一种元素。(已知F为红褐色沉淀)
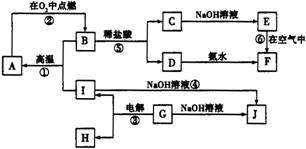
请填写下列空白:
(1)物质G的化学式是________。
(2)写出反应⑤的化学方程式________,写出反应④的离子方程式________。
(3)反应①~⑥中,不属于氧化还原反应的是________。(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) ▲0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= ▲ mol·L-1,c (H+) − c (MOH) = ▲ mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 ▲ (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 ▲ 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH ▲ 7(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,调节反应条件以后,反应产物不会改变的是( )
A.钠与氧气 B.NaOH溶液和Al2(SO4)3溶液
C.盐酸与铁粉 D.二氧化碳与氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种化合物,其中A、B、C、D都是含有Al元素的化合物,F是一种气体,在标准状况下,F的密度是相同条件下空气的1.103倍。化合物间可发生如下反应:
a.A+NaOH→D+H2O b.B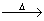 A+H2O
A+H2O
c.C+NaOH (适量)→B+NaCl d.E+H2O→NaOH+F
(1)写出化学式A.________ B.________ C.________ D.________
(2)1 mol C和2 mol E在水溶液中发生反应的化学方程式为:_______________________,其中氧化剂是__________,氧化产物是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
理论上不能用于设计成原电池的反应是
A. 2H2(g)+O2(g)==2H2O(l) △H<0 B. HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) △H<0
C. 2Al(s)+3Cl2(g)==2AlCl3(s) △H<0 D. Zn(s)+2HCl(aq)==ZnCl2+H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)===2H2O(l) 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)  2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_________ _______。
(3)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)===2H2O(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为____ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
CO和CO2的混合气体18 g,完全燃烧后测得CO2的体积为11.2 L(标准状况)。试回答:
(1)混合气体中CO的质量是________。
(2)混合气体中CO2在标准状况下的体积是________。
(3)混合气体在标准状况下的密度是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com