
将6 mol A和5 mol B混合于4 L恒容密闭容器中,发生如下反应:3A(g)+B(g)  nC(g)+2D(g)
nC(g)+2D(g)
5 s后反应达到平衡状态,生成2 mol D,经测定以C表示的平均反应速率为0.1 mol·L-1·s-1。则下列结论中正确的是
A.5 s内以A表示的平均反应速率为0.15 mol·L-1·s-1
B.平衡时,B的浓度为1 mol·L-1
C.n值等于1
D.平衡时B的转化率为50%
【知识点】化学反应速率、平衡转化率
【答案解析】AB 解析:5 s后反应达到平衡状态,生成2 mol D,以D表示的平均反应速率为0.1 mol·L-1·s-1根据用不同物质表示同一速率时速率比等于方程式的系数比,得到n=2,5 s内以A表示的平均反应速率为0.15 mol·L-1·s-1 故A正确;C错误;B、以B表示的平均反应速率为0.05 mol·L-1·s-1,5 sB减少1mol,平衡时,B的浓度为1 mol·L-1,故B正确;;D、平衡时B的转化率为:1/5×100%=20%,故D错误;
故答案选AB
【思路点拨】本题主要考查化学反应速率、平衡转化率的计算,既要掌握有关公式,又要理解用不同物质表示同一速率时速率比等于方程式的系数比。


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
在一个固定体积为2升的密闭容器中,充入2molA和1molB,发生如下反应: 2A(g)+B(g) 3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
3C(g)+D(s),2分钟反应达到平衡,此时C的浓度为1.2 mol/L。
(1)2分钟内用B表示的平均反应速度为 ;
(2)若容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为:
(填“吸热”或“放热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
阅读材料,回答下列问题。
近年来,科技人员研究得到一种新型材料——泡沫铝。它是把发泡剂加到熔融或固体粉末的铝合金中而制成的,其优点是硬度高,密度小(约为0.16 g/cm3~0.5 g/cm3),比木材还轻,可浮于水面,又有很大刚性,且隔音、保温,是一种良好的建筑材料和轻质材料,近几年就可大批量投放市场。
(1)下列关于泡沫铝的说法错误的是( )。
A.泡沫铝即是铝单质泡沫
B.泡沫铝是一种合金
C.泡沫铝是一种优质的建筑材料和轻质材料
D.泡沫铝可用于飞机制造
(2)铝制成铝箔做食品包装,是利用它的( )。
A.金属光泽 B.延展性 C.导电性 D.导热性
(3)铝在空气中会被氧化生成一层致密的氧化膜(氧化物)而对铝起保护作用,但这层氧化膜(氧化物)遇到强酸或强碱都会溶解,请写出:
与盐酸反应的离子方程式:________。
与氢氧化钠溶液反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A~J分别表示中学化学中常见的物质,它们之间的相互转化关系如图所示(部分反应物、生成物没有列出)。已知:G为金属元素的固态氧化物(常温下);A、B、C、D、E、F六种物质中均含有同一种元素。(已知F为红褐色沉淀)
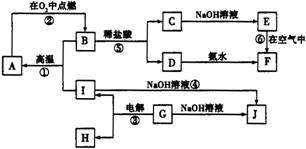
请填写下列空白:
(1)物质G的化学式是________。
(2)写出反应⑤的化学方程式________,写出反应④的离子方程式________。
(3)反应①~⑥中,不属于氧化还原反应的是________。(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各溶液pH最小的是
A.pH=0的溶液 B.0.04 mol·L-1 H2SO4
C.0.5 mol·L-1 HCl D.0.05 mol·L-1CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)混合溶液中由水电离出的c (H+) ▲0.2 mol·L-1 HCl溶液中由水电离出的c (H+) (填“>、<或=”)。
(2)求出混合物中下列算式的精确计算结果(填具体数字):
c (Cl-) − c (M+)= ▲ mol·L-1,c (H+) − c (MOH) = ▲ mol·L-1 。
(3)若常温下取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,说明MOH的电离程度 ▲ (填“>、<或=”)MCl的水解程度。溶液中各离子浓度由大到小的顺序为 ▲ 。
(4)若常温下pH=3的盐酸与pH=11的氨水溶液等体积混合,则混合溶液的pH ▲ 7(填“>、<或=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,调节反应条件以后,反应产物不会改变的是( )
A.钠与氧气 B.NaOH溶液和Al2(SO4)3溶液
C.盐酸与铁粉 D.二氧化碳与氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
理论上不能用于设计成原电池的反应是
A. 2H2(g)+O2(g)==2H2O(l) △H<0 B. HCl(aq)+NaOH(aq)==NaCl(aq)+H2O(l) △H<0
C. 2Al(s)+3Cl2(g)==2AlCl3(s) △H<0 D. Zn(s)+2HCl(aq)==ZnCl2+H2(g) △H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)(4分)物质的量是一个联系宏观和微观的物理量。填写关于物质的量计算的四个恒等式(NA表示阿伏加德罗常数):
n= = = = 。
(2)(5分)同温同压下,同体积的N2和SO2分子数之比为 ,物质的量之比为 ,原子总数之比为 ,摩尔质量之比为 ,质量之比为 。
(3)(1分)若某原子的摩尔质量为M g·mol-1,则一个该原子的真实质量是__________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com