
【题目】山梨酸和苯甲酸都是制备防腐剂的原料,他们的键线式如图所示。下列说法正确的是( )
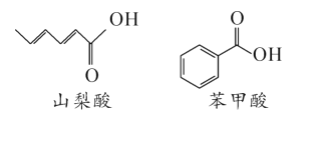
A.它们都能发生加成和氧化反应
B.苯甲酸分子中所有的原子共平面
C.山梨酸和苯甲酸互为同系物
D.山梨酸与足量H2反应后所得产物的一氯代物有6种(不考虑立体异构)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在 Cu-ZnO-ZrO2 催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H,带*标记的物质是该反应历程中的中间产物或过渡态)。下列说法错误的是
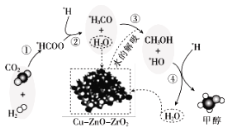
A.第①步中CO2和H2分子中都有化学键断裂
B.水在整个历程中可以循环使用,整个过程不消耗水也不产生水
C.第③步的反应式为:*H3CO+H2O→CH3OH+*HO
D.第④步反应是一个放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源,最近科学家研制出利用太阳能产生激光,在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
(1)太阳光分解海水时,实现了_____能转变为_______能,二氧化钛作_______。生成的氢气用于燃料电池时,实现了_______能转变为_______能。太阳光分解海水的反应属于_______(填“放热”或“吸热”)反应。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)请根据下列信息,写出H2燃烧热的热化学方程式________。
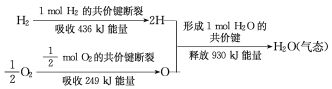
H2O(l) = H2O(g) ΔH = +44kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用碳酸钠晶体(Na2CO3·10H2O,相对分子质量286)来配制0.1mol/L的碳酸钠溶液980mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是
A. 称取碳酸钠晶体28.6g
B. 溶解时进行加热,并将热溶液转移到容量瓶中至刻度线
C. 转移时,对用于溶解碳酸钠晶体的烧杯没有进行洗涤
D. 定容后,将容量瓶振荡摇匀,静置发现液面低于刻度线,又加入少量水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z的原子序数依次增大,且都不超过10.这四种元素可组成一种化合物的结构如图所示。下列说法正确的是( )
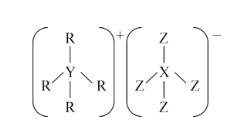
A.常温常压下,上述元素的单质都呈气态
B.最高价氧化物对应水化物的酸性:X>Y
C.Y、Z的气态氢化物能发生化合反应
D.由R、X两种元素只能形成一种化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
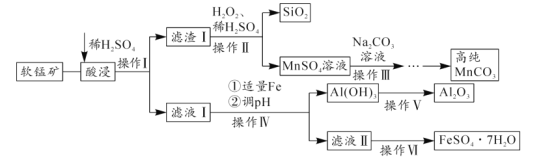
【题目】软锰矿的主要成分为MnO2,还含有SiO2、Al2O3、Fe2O3、FeO等杂质。软锰矿经过综合利用,可制备碳酸锰、氧化铝及绿矾( FeSO47H2O),其制备过程如图:
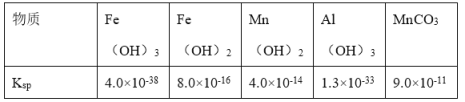
部分物质的Ksp如表:
回答下列问题:
(1)操作I中需要的仪器有______(填字母序号)。
a.蒸发皿 b.酒精灯c.漏斗 d.玻璃棒 e.烧杯
(2)操作Ⅱ中反应的离子方程式为______。
(3)操作Ⅲ中也可用NaHCO3与MnSO4溶液反应制备碳酸锰,其反应的离子方程式为______。
(4)操作Ⅳ中加入适量Fe的目的是______;当调节pH=______时(结果保留整数),可确定Al(OH)3完全沉淀。(已知:完全沉淀后,溶液中离子浓度不高于10-5molL-1)
(5)操作Ⅵ中一般要加入稀硫酸,目的是______,然后______、冷却结晶、______、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予美国科学家约翰古迪纳夫、斯坦利惠廷厄姆和日本科学家吉野彰,以表彰他们在锂离子电池研发领域作出的贡献。近日,有化学家描绘出了一种使用DMSO(二甲基亚砜)作为电解液,并用多孔的黄金作为电极的锂—空气电池的实验模型,该电池放电时在多孔的黄金上氧分子与锂离子反应,形成过氧化锂(Li2O2),其装置图如图所示。下列有关叙述正确的是
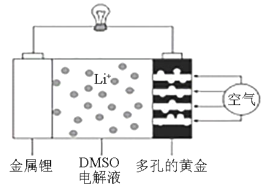
A.DMSO电解液能传递Li+和电子,不能换成水溶液
B.该电池放电时每消耗2molO2,转移4mol电子
C.该池放电时,外电路中电流的方向为从金属锂电极流出
D.多孔的黄金为电池正极,电极反应式可能为O2+4e-=2O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是
A. 标准状况下3.6 g H2O含有的电子数为2NA
B. 2.8 g乙烯与聚乙烯的混合物含有的极性键为0.4NA
C. 0.l moI Cl2与足量的铁粉充分反应转移的电子数为0.2NA
D. 1 L 0.2 mol/l的K2Cr2O7溶液中![]() 的数目为0.2NA
的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室为准确测定FeSO4的浓度,可用重铬酸钾标准溶液进行滴定。(已知重铬酸钾被还原为Cr3+)
步骤1.用分析天平准确称取2.9400g重铬酸钾,配制500mL重铬酸钾标准溶液;
步骤2.移取25.00mL所配制的重铬酸钾标准溶液于500mL锥形瓶中,用蒸馏水稀释至250mL,再加20mL浓硫酸,冷却后,加2~3滴试亚铁灵指示剂;
步骤3.用待测硫酸亚铁溶液滴定至溶液由橙黄到绿,由绿色刚变为红紫色为终点;
步骤4.记录消耗硫酸亚铁溶液的体积为18.70 mL。
(1)配制500mL重铬酸钾标准溶液需要的玻璃仪器有量筒、烧杯、 ____________________
(2)移取K2Cr2O7溶液选用的仪器是___________,盛装待测硫酸亚铁溶液选用的仪器是___________
A.50mL酸式滴定管 B.25mL碱式滴定管 C.25mL量筒
(3)氧元素位于周期表的______分区,铁元素在周期表中的位置是___________________,Fe2+的简化电子排布式为_________________,基态铬原子的价电子电子排布图为 __________________。
(4)测得FeSO4的浓度为 ______________ 。(小数点后保留两位数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com