
【题目】氢气是未来最理想的能源,最近科学家研制出利用太阳能产生激光,在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O![]() 2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。请回答下列问题:
(1)太阳光分解海水时,实现了_____能转变为_______能,二氧化钛作_______。生成的氢气用于燃料电池时,实现了_______能转变为_______能。太阳光分解海水的反应属于_______(填“放热”或“吸热”)反应。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应分别为:A极:2H2+2O2--4e-=2H2O;B极:O2+4e-=2O2-,则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
(3)请根据下列信息,写出H2燃烧热的热化学方程式________。
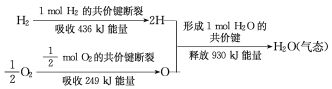
H2O(l) = H2O(g) ΔH = +44kJ/mol
【答案】太阳 化学 催化剂 化学 电 吸热 负 流出 H2(g) +![]() O2(g) = H2O(l) ΔH = -289kJ/mol
O2(g) = H2O(l) ΔH = -289kJ/mol
【解析】
(1)水在催化剂和激光条件下分解,属于吸热反应,
(2)根据原电池原理分析,负极发生氧化反应,正极发生还原反应,电流从正极流出,电子的方向与电流相反;
(3)由燃烧热的定义及盖斯定律书写;
(1) 科学家利用太阳能在催化剂(二氧化钛)作用下,使海水分解生成氢气和氧气,在这个过程中太阳能转变为化学能,生成的氢气用于燃料电池时,是把化学能转变为电能,氢气在氧气中燃烧是放热反应,水分解为氧气和氢气是吸热反应;答案是:太阳; 化学; 催化剂 ;化学; 电;吸热;
(2)氢氧燃料电池工作时, 氢气在负极发生氧化反应,氧气在正极发生还原反应,A极反应为2H2+2O2--4e-=2H2O,氢气失去电子发生氧化反应,所以A极是负极,原电池中电流从正极流出,电子的流向与电流方向相反,所以电子从负极流出,即电子从A极流出,答案为:负;流出;
(3) ΔH=反应物的键能总和—生成物的键能总和,由信息可知反应①H2(g)+![]() O2(g)=H2O(g)的ΔH=(436+249-930) kJ/mol=-245 kJ/mol,又知反应②H2O(l) = H2O(g) ΔH = +44kJ/mol,H2的燃烧热是指1mol H2完全燃烧生成稳定的氧化物即液态水所放出的热量,根据盖斯定律,用反应①-②可得到:H2(g) +
O2(g)=H2O(g)的ΔH=(436+249-930) kJ/mol=-245 kJ/mol,又知反应②H2O(l) = H2O(g) ΔH = +44kJ/mol,H2的燃烧热是指1mol H2完全燃烧生成稳定的氧化物即液态水所放出的热量,根据盖斯定律,用反应①-②可得到:H2(g) +![]() O2(g) = H2O(l) ΔH =(-245-44) kJ/mol= -289kJ/mol,答案为:H2(g) +
O2(g) = H2O(l) ΔH =(-245-44) kJ/mol= -289kJ/mol,答案为:H2(g) +![]() O2(g) = H2O(l) ΔH = -289kJ/mol。
O2(g) = H2O(l) ΔH = -289kJ/mol。


科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室分别用以下4个装置完成实验。下列有关装置、试剂和解释都正确的是
A.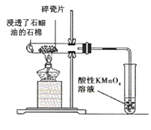 中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
中碎瓷片为反应的催化剂,酸性KMnO4溶液褪色可证明有乙烯生成
B. 所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
所示装置(秒表未画出)可以测量锌与硫酸溶液反应的速率
C.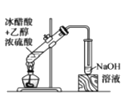 为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
为实验室制备乙酸乙酯的实验,浓硫酸起到催化剂和脱水剂的作用
D. 为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
为铜锌原电池装置,盐桥中的阳离子向右池迁移起到形成闭合电路的作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )
A. 该合金中铜与镁的物质的量之比是2:1
B. NO2和N2O4的混合气体中,NO2的体积分数是80%
C. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为-393.5 kJ/mol、-285.8 kJ/mol、-870.3 kJ/mol,则![]() CH3COOH(l)═C(s)+H2(g)+
CH3COOH(l)═C(s)+H2(g)+![]() O2(g)的反应热为( )
O2(g)的反应热为( )
A.-191 kJ/molB.+191 kJ/molC.+244.15 kJ/molD.+488.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)如图是配制50 mL KMnO4标准溶液的过程示意图。


(1)请你观察图示判断,其中不正确的操作有(填序号)________。
(2)其中确定50 mL溶液体积的容器是(填名称)________。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)已知草酸跟KMnO4溶液反应的离子方程式为:
2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O则方程式中的x=________。
(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼元素为人体及动植物必须的微量元素,也在钢铁工业中有着重要的作用,钼作为钢的合金化元素,可以提高钢的强度,特别是高温强度和韧性。我国钼元素的储量丰富,在世界上占第二位。如图所示是钼元素的相关信息,下列有关钼的说法错误的是
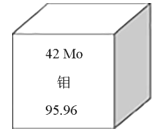
A.95Mo18O42-(钼酸根离子)中共计有76个电子
B.Mo元素是第五周期的主族元素
C.92Mo、95Mo、98Mo互为同位素,化学性质几乎相同
D.98Mo的原子核内中子数比质子数多14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】山梨酸和苯甲酸都是制备防腐剂的原料,他们的键线式如图所示。下列说法正确的是( )
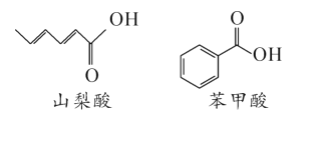
A.它们都能发生加成和氧化反应
B.苯甲酸分子中所有的原子共平面
C.山梨酸和苯甲酸互为同系物
D.山梨酸与足量H2反应后所得产物的一氯代物有6种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的绿色能源之一,目前科学家用水煤气(CO+H2)合成甲醇,其反应为:CO(g)+2H2(g) ![]() CH3OH(g)△H=-128.1kJ·mol-1
CH3OH(g)△H=-128.1kJ·mol-1
回答下列问题:
(1)该反应是可逆反应,为使化学反应速率和CO的转化率都同时提高的措施有_____。
A、升高温度 B、增大压强 C、充入氢气 D、分离出甲醇
(2)恒温恒容条件能说明该可逆反应达平衡的是_________;
A.2v正(H2)=v逆(CH3OH)
B.n(CO):n(H2):n(CH3OH)=1:2:1
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
(3)若上述可逆反应在恒温恒容的密闭容器进行,起始时间向该容器中充入1molCO(g)和2molH2(g)。实验测得H2的平衡转化率随温度(T)、压强(P)的变化如图所示。
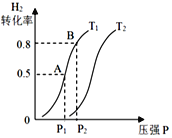
①该反应的△S____0,图中的T1___T2(填“<”“>”或“=”)
②T1下到达平衡状态A时,容器的体积为2L,此时该反应的平衡常数为______,若达到平衡状态B时,则容器的体积V(B)=______L。
(4) CO燃烧的热化学方程式:CO(g)+ 1/2 O2(g)═CO2(g)△H= —283.0kJmol-1
H2(g)+1/2 O2(g)═H2O(l)△H= —285.8 kJmol-1
CO(g)+2H2(g)═CH3OH(l)△H= —128.1KJmol-1
则CH3OH(g)燃烧热的热化学方程式是为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com