
科目:高中化学 来源: 题型:阅读理解
 某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4·yCu(OH)2]。为了加以验证,小组成员进行了如下实验:
①分别配制50mL物质的量浓度均为0.L00mol.L-1CuSO4溶液和NaOH溶液;
②准确量取l0mLCuSO4溶液倒入50mL烧杯中;
③向烧杯中匀速加入0.l00mol.L—NaOH溶液,并每加入1.00mLNaOH溶液用pH计测一次混合溶液的pH;
④当滴人NaOH溶液的体积达到30mL时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时pH变化曲线。
请回答以下问题:
(1)V(NaOH)在0.00mL~2.00mL之间时,溶液中无沉淀产生,但pH变化较快的原因是 ;
(2)V(NaOH)在2.00mL~ 15.00mL之间时,溶液中产生绿色沉淀,并不断增加,
经检测此沉淀为碱式硫酸铜。已知蒸馏水的pH为6.32,当V(NaOH)为15.00mL时,溶液pH为6.30,则可求得x= ,y= ;
(3)V(NaOH)在17.00mL~20.00mL之间时,溶液中出现蓝色沉淀,并不断增
加。已知V(NaOH)为20.00mL时,溶液pH为12.25,则此时沉淀中 (填
“含”或“不含”)有碱式硫酸铜,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
①分别配置50mL物质的量浓度均为0.100mol/L的CuSO4溶液和NaOH溶液;
②准确量取10mL CuSO4溶液倒入50ml烧杯中
③向烧杯中匀速加入0.100 mol/L的NaOH溶液,并每加入1.00mlNaOH溶液用pH计测一次混合溶液的pH
④当滴入NaOH溶液的体积达到30ml时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时PH变化曲线。如右图
请回答下列问题:
(1)配置溶液时需要使用烧杯、 、 等玻璃仪器;下列仪器中可用于向烧杯中加入NaOH溶液的仪器是 A. 胶头滴管 B.酸式滴定管 C.碱式滴定管 D.量筒
(2)V(NaOH)在2.00ml~15.00ml之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜。当V(NaOH)为15.00ml时,溶液PH为6.32(已知蒸馏水的PH为6.32),则可求得x= y=
(3)V(NaOH)在17.00ml~20.00ml之间时,溶液中出现蓝色沉淀,并不断增加。已知V(NaOH)为20.00ml时,溶液PH为12.25,则此时沉淀中 (填“含”或“不含”)有碱式硫酸铜,请设计实验方案加以证明:
查看答案和解析>>
科目:高中化学 来源:2012届浙江省杭州市高三上学期期中七校联考化学试卷 题型:填空题
(10分)某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
①分别配置50mL物质的量浓度均为0.100mol/L的CuSO4溶液和NaOH溶液;
②准确量取10mL CuSO4溶液倒入50ml烧杯中
③向烧杯中匀速加入0.100 mol/L的NaOH溶液,并每加入1.00mlNaOH溶液用pH计测一次混合溶液的pH
④当滴入NaOH溶液的体积达到30ml时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时PH变化曲线。如右图
请回答下列问题:
(1)配置溶液时需要使用烧杯、 、 等玻璃仪器;下列仪器中可用于向烧杯中加入NaOH溶液的仪器是
| A.胶头滴管 | B.酸式滴定管 | C.碱式滴定管 | D.量筒 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省无锡市高三上学期期中考试化学试卷(解析版) 题型:实验题
(12分)某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4·yCu(OH)2]。为了加以验证,小组成员进行了如下实验:
①分别配制50mL物质的量浓度均为0.L00mol.L-1CuSO4溶液和NaOH溶液;
②准确量取l0mLCuSO4溶液倒入50mL烧杯中;
③向烧杯中匀速加入0.l00mol.L—NaOH溶液,并每加入1.00mLNaOH溶液用pH计测一次混合溶液的pH;
④当滴人NaOH溶液的体积达到30mL时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时pH变化曲线。
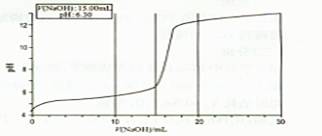
请回答以下问题:
(1)V(NaOH)在0.00mL~2.00mL之间时,溶液中无沉淀产生,但pH变化较快的原因是 ;
(2)V(NaOH)在2.00mL~ 15.00mL之间时,溶液中产生绿色沉淀,并不断增加,
经检测此沉淀为碱式硫酸铜。已知蒸馏水的pH为6.32,当V(NaOH)为15.00mL时,溶液pH为6.30,则可求得x= ,y= ;
(3)V(NaOH)在17.00mL~20.00mL之间时,溶液中出现蓝色沉淀,并不断增
加。已知V(NaOH)为20.00mL时,溶液pH为12.25,则此时沉淀中 (填
“含”或“不含”)有碱式硫酸铜,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com