
2012��3��21 ���ǵڶ�ʮ��������ˮ����������ˮ��Դ����������
(1)ClO2��Cl2(��ԭ���ﶼΪCl��)�������г��õ��������������ĵ����ʵ�������������ʱ��ClO2������Ч����Cl2��________����
(2)ij��ɫ��ˮ�п��ܺ���Fe3����Al3����Mg2����Na����NO3����CO32����SO42�������еļ��֣�Ϊ������ɷ֣��ֱ�ȡ��ˮ��Ʒ100 mL������������ʵ�飬��������й���������ͼ��ʾ��


�������ͼ�ش��������⣺
��ʵ����������1.0 mol/L��NaOH��Һ100 mL�������������˲�������������ƽ����Ͳ��ҩ�ס��ձ�����ͷ�ιܣ���ȱ�ٵ�����Ϊ_________________________________________��
��ʵ�����г�������A��B��������������Ӧ�����ӷ���ʽΪ____________________��
����ȷ��NO3���Ƿ���ڣ�________(����������������������������ȷ����)�������ڣ��Լ���c(NO3��)��________(�������ڣ����ʲ�������)��
(1)2.5��(2)��100mL����ƿ����Al(OH)3��OH��=AlO2����2H2O���� ���ڡ�0.15 mol/L
��������(1)һ�� ClO2����Cl�����õ�5�����ӣ�һ��Cl2����2��Cl�����õ�2�����ӣ�����ClO2������Ч����Cl2��2.5����
(2)����Ҫ100 mL����ƿ������Ӧ�����ӷ���ʽΪAl(OH)3��OH��=AlO2����2H2O��
����ɫ��ˮ������Fe3�� ����ɫ��Ӧ��ɫ������Na�������ˮ�мӹ�������������Һ�а�ɫ�������ɣ����в����ܽ�������Mg2�� �� Al3������Һ�к���Mg2����Al3����һ������CO32������ɫ����BaSO4 2.33 g�����ʵ���Ϊ0.01 mol��SO42�������ʵ���Ҳ��0.01 mol��
n(NaOH)��n(Al3��)��0.005 mol
n[Mg(OH)2]��n(Mg2��)��0.01 mol
����������ӵ����ʵ�����X��������Һ���������ӵ���غ�֪��
0��01��2��0.005��3��X��0.01��2��X��0.015 mol


 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
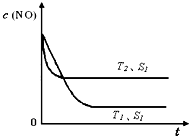 ��2012?��ɽ��ģ��2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
��2012?��ɽ��ģ��2012��2��27���������ƽ��롰200��������ʱ����������β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com