
【题目】绿矾(FeSO47H2O)在化学合成上用作还原剂及催化剂,工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾。
(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为______(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为______(填>、<、=)40%。
(2)实际生产用20%发烟硫酸(100克发烟硫酸含SO320克)配制稀硫酸,若用SO3nH2O表示20%的发烟硫酸,则n=______(保留两位小数)。
(3)某厂废水中含1.00×10﹣3mol/L的Cr2O72-,其毒性较大.某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4 (Cr的化合价为+3,Fe的化合价依次为+3、+2).欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4.理论上需要加入______g FeSO47H2O。
(4)硫酸亚铁铵[(NH4)2SO4FeSO46H2O](俗称莫尔盐),较绿矾稳定,在分析化学中常用来配制Fe2+的标准溶液,用此Fe2+的标准溶液可以测定剩余稀硝酸的量.现取8.64克Cu2S和CuS的混合物用200mL2mol/L稀硝酸溶液处理,发生反应如下:
10NO3﹣+3Cu2S+16H+→6Cu2++10NO↑+3SO42﹣+8H2O
8NO3﹣+3CuS+8H+→3Cu2++3 SO42﹣+8NO↑+4H2O
剩余的稀硝酸恰好与48mL 2mol/L (NH4)2Fe(SO4)2溶液完全反应.
已知:NO3﹣+3Fe2++4H+→NO↑+3Fe3++2H2O
试计算混合物中CuS的质量分数(保留两位小数)。______________
【答案】7.14molL﹣1 > 0.77 2.78 33.33%
【解析】
(1)根据![]() 计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
(2)20%发烟硫酸可表示为SO3nH2O,通过整理即为:nH2SO4(1-n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1-n)=(1-20%):20%,解出n即可;
(3)根据Cr原子计算Cr0.5Fe1.5FeO4的物质的量,结合Cr0.5Fe1.5FeO4的物质的量利用Fe原子守恒计算FeSO47H2O质量;
(4)先根据(NH4)2Fe(SO4)2的物质的量计算与其反应的硝酸的物质的量,设固体混合物中两固体的质量,根据两固体的质量计算需要的硝酸的物质的量,然后列式计算出两固体的质量,根据质量分数公式计算即可。
(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为![]() ≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%;
(2)20%发烟硫酸可表示为SO3nH2O,通过整理即为:nH2SO4(1n)SO3,根据20%发烟硫酸中H2SO4和SO3的质量关系可得:98n:80(1n)=(120%):20%,解得n=0.77;
(3)1L废水中含![]() =1.00×103mol,根据Cr原子、Fe原子守恒,可得:
=1.00×103mol,根据Cr原子、Fe原子守恒,可得:![]() ~4Cr0.5Fe1.5FeO4~10FeSO47H2O,
~4Cr0.5Fe1.5FeO4~10FeSO47H2O,
所以理论上n(FeSO47H2O)=10n(![]() )=1.00×103mol×10=0.01mol,
)=1.00×103mol×10=0.01mol,
所以m(FeSO47H2O)=0.01mol×278g/mol=2.78g;
(4)48mL(NH4)2Fe(SO4)2溶液完全反应需要硝酸的物质的量为:
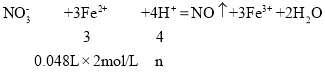
解得:n=0.128mol,所以消耗的硝酸的物质的量为0.128mol,故与固体混合物反应的硝酸的物质的量为:0.4mol0.128mol=0.272mol,
设Cu2S的物质的量xmol,CuS的物质的量为ymol,160x+96y=8.64g①,
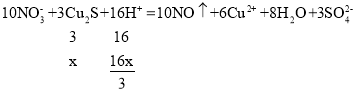

![]() ②
②
由①②解得:x=0.036mol,y=0.03mol,
合物中CuS的质量分数为![]() ≈33.33%,因此混合物中CuS的质量分数为33.33%。
≈33.33%,因此混合物中CuS的质量分数为33.33%。


科目:高中化学 来源: 题型:
【题目】有机物M的结构简式为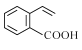 ,下列说法正确的是 ( )
,下列说法正确的是 ( )
A.有机物M既能使酸性KMnO4溶液褪色又能使溴水褪色,且反应类型相同
B.与有机物M具有相同的官能团,且不包括M的同分异构体有3种
C.1mol有机物M与足量氢气反应,消耗氢气4mol
D.有机物M能发生取代、加成、氧化、水解等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
Ⅰ直接脱硝
(1)NO在催化剂作用下分解为氮气和氧气。在10L密闭容器中,NO经直接脱硝反应时,其物质的量变化如图1所示。则0~5min内氧气的平均反应速率为___mol/(Lmin)。

Ⅱ臭氧脱硝
(2)O3氧化NO结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为___。
Ⅲ氨气脱硝
(3)实验室制取纯净的氨气,除了氯化铵外,还需要___、___(填写试剂名称)。不使用碳酸铵的原因是___(用化学方程式表示)。
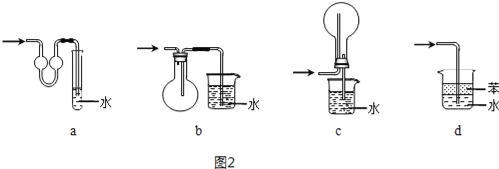
(4)吸收氨气时,常使用防倒吸装置,图2装置不能达到此目的是___。
NH3脱除烟气中NO的原理如图3:
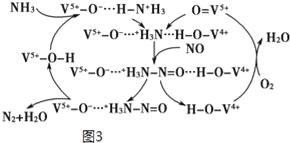
(5)该脱硝原理中,NO最终转化为___(填化学式)和H2O。当消耗1molNH3和0.25molO2时,除去的NO在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是( )
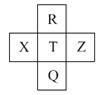
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:R>Q
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4molA和 2molB进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
4C(s)+2D(g)。反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是( )
A.该反应的化学平衡常数表达式是 K=![]()
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加 B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下有可逆反应:A(g)+2B(g)![]() 2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
2C(g)+D(g)。现将5mol A和10mol B加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示.下列有关说法正确的是
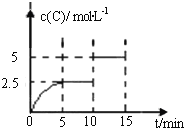
A.在0~5min内,正反应速率逐渐增大
B.反应从起始至5min时,B的转化率为50%
C.5min时的平衡常数与10min时的平衡常数不等
D.第15min时,B的体积分数为25%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中氮氧化物(NO与NO2)是主要的大气污染物之一,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:4NO+4NH3+O2![]() 4N2+6H2O;6NO2+8NH3
4N2+6H2O;6NO2+8NH3![]() 7N2+12H2O。
7N2+12H2O。
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化合物的平均相对分子质量为___。
(2)尾气中NO的含量为___mg/m3。
(3)要处理5m3的尾气,需要氨氧混合气的体积为___L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积的25%NaOH溶液(密度1.28g/cm3)完全吸收。
(4)NaOH溶液的物质的量浓度为___mol/L,体积为___mL。
(5)已知反应后溶液中含有0.35molNaNO2。若将尾气中NO与NO2的平均组成记为NOx,通过计算求x___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
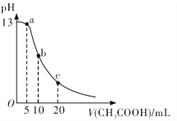
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com