
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
【答案】B
【解析】
根据反应中元素化合价的变化可知,放电时,Fe为负极,失电子发生氧化反应生成Fe(OH)2,电极反应式为Fe-2e-+2OH-=Fe(OH)2,Ni2O3为正极,得电子发生还原反应生成Ni(OH)2,电极反应式为Ni2O3+2e-+3H2O=2Ni(OH)2+2OH-,原电池充电时,发生电解反应,此时阴极反应为原电池负极反应的逆反应,阳极反应为原电池正极反应的逆反应。
A项、放电时, Fe为负极,失电子发生氧化反应生成Fe(OH)2,电极反应式为Fe-2e-+2OH-=Fe(OH)2,故A正确;
B项、Ni2O3为正极,得电子发生还原反应生成Ni(OH)2,故B错误;
C项、充电时,阳极反应为原电池正极反应的逆反应,则阳极上的电极反应式为2Ni(OH)2 -2e-+2OH-=Ni2O3 +3H2O,故C正确;
D项、由总方程式可知电池为碱性电池,反应方程式中不能出现H+,只能浸在碱性电解质溶液中,故D正确;
故选B。


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,将2molSO2和1molO2充入一固定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-197kJ/mol,当达到化学平衡时,下列说法中正确的是
2SO3(g) △H=-197kJ/mol,当达到化学平衡时,下列说法中正确的是
A.SO2和SO3共2mol B.生成 SO32mol
C.放出197kJ热量 D.含氧原子共8mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学计量是化学学习中的重要工具,请根据物质的量有关知识填空(NA表示阿伏伽德罗常数)
(1) _____molCO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)标准状况下,体积为11.2L的N2的质量是_____g,所含质子数目为___。
(3)0.2L0.5mol/LAl2(SO4)3溶液和0.5L 0.5mol/L Na2SO4溶液,所含SO42—离子的物质的量浓度之比为____。
(4)标准状况下,NH3和CH4组成的混合气体的密度为0.75g/L,则NH3的体积分数为___。
(5)标准状况下,将VLA气体(摩尔质量为M g/ mol )溶于0.1L水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入A(体积不变)时混合物的颜色________,加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是某化学兴趣小组根据教材知识设计的证明Na2CO3与NaHCO3热稳定性的套管实验。下列叙述中不正确的是( )
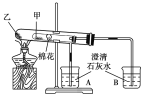
A. 甲为NaHCO3,乙为Na2CO3
B. 要证明NaHCO3受热能产生水,可在小试管内放置沾有少量无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯中的澄清石灰水变浑浊
D. 整个实验过程中A烧杯中的澄清石灰水不会变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备胶体: Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.钠与CuSO4溶液反应:2Na+Cu2+=Cu +2Na+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是_______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用___________mL量筒最好。
②配制时所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有:___________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足
B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.金刚石的一个晶胞中含有6个碳原子。
B.12 g石墨中六元环的数目为0.5NA。
C.1个干冰晶胞的质量为![]() ×44 g。
×44 g。
D.以面心立方最密堆积形成的晶胞中金属含有4个金属原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20 g NaOH固体溶于水配成100 mL溶液,其密度为1.185 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为______mol·L-1。
(2)从该溶液中取出10 mL,其中NaOH的物质的量浓度为_____ mol· L-1,含NaOH的物质的量为______mol。
(3)将取出的10 mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1 mol·L-1,稀释后溶液体积为___ mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com