
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是_______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用___________mL量筒最好。
②配制时所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有:___________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足
B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
【答案】12 BD 16.7 50 500mL容量瓶、胶头滴管 AD
【解析】
(1)根据c=![]() 计算出浓盐酸的物质的量浓度;
计算出浓盐酸的物质的量浓度;
(2)根据各量的计算公式是否与体积有关判断;
(3)①根据稀释前后溶质的物质的量不变计算浓溶液的体积;②根据配制一定物质的量浓度的溶液步骤分析;③根据c=![]() 分析判断。
分析判断。
(1)该浓盐酸的物质的量浓度为![]() =
=![]() mol/L =12mol/L,故答案为:12;
mol/L =12mol/L,故答案为:12;
(2)任何溶液都是均一稳定的分散系,任何体积溶液的密度和浓度不变,而体积不同时,溶质的物质的量不同,溶液中离子的数目也不同,故选BD;
(3)①配制480mL溶液,实验室没有480mL容量瓶,应该配制500mL 0.400mol/L的溶液,根据溶液稀释前后溶质的物质的量不变,有c1V1=c2V2,V1=![]() =0.0167L=16.7mL,配制溶液需要量取16.7mL浓盐酸,根据题意,只能选用50mL量筒,故答案为:16.7;50;
=0.0167L=16.7mL,配制溶液需要量取16.7mL浓盐酸,根据题意,只能选用50mL量筒,故答案为:16.7;50;
②利用浓盐酸稀释配制500mL稀盐酸溶液,需要的仪器有:量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管等,则配制仪器除烧杯、量筒和玻璃棒外,还需要的仪器是500mL容量瓶、胶头滴管,故答案为:500mL容量瓶、胶头滴管;
③A.浓盐酸挥发,导致浓盐酸的浓度减小,量取的浓盐酸中氯化氢的物质的量减小,根据c=![]() 可得,配制的溶液浓度偏低,故A正确;B.配制时,容量瓶未干燥有少量蒸馏水,对溶液体积和溶质的物质的量都没有影响,所以不影响配制结果,故B错误;C.俯视容量瓶刻度线,导致溶液的体积偏小,根据c=
可得,配制的溶液浓度偏低,故A正确;B.配制时,容量瓶未干燥有少量蒸馏水,对溶液体积和溶质的物质的量都没有影响,所以不影响配制结果,故B错误;C.俯视容量瓶刻度线,导致溶液的体积偏小,根据c=![]() 可得,配制的溶液浓度偏大,故C错误;D.加蒸馏水时不慎超过了刻度线,导致配制的溶液体积偏大,根据c=
可得,配制的溶液浓度偏大,故C错误;D.加蒸馏水时不慎超过了刻度线,导致配制的溶液体积偏大,根据c=![]() 可得,溶液浓度偏低,故D正确;故答案为:AD。
可得,溶液浓度偏低,故D正确;故答案为:AD。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__。
②请写出CO和NO生成无污染气体的热化学方程式为__。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
①下列说法正确的是__。
A.实验2容器内压强比实验1的小
B.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
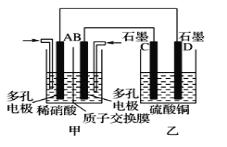
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__(填化学式);A电极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.![]() 离子中心原子上的孤电子对数是1,立体构型为平面三角形
离子中心原子上的孤电子对数是1,立体构型为平面三角形
B.元素周期表第三周期主族元素中,简单离子半径最小的是![]()
C.金刚石转化为石墨为放热反应,说明相同条件下石墨比金刚石稳定
D.![]() 、
、![]() 都是非极性分子
都是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 五种元素的原子序数依次递增。已知:①
五种元素的原子序数依次递增。已知:①![]() 位于周期表中第四周期
位于周期表中第四周期![]() 族,其余的均为短周期主族元素:②
族,其余的均为短周期主族元素:②![]() 的氧化物是光导纤维的主要成分;③
的氧化物是光导纤维的主要成分;③![]() 原子核外
原子核外![]() 层电子数为奇数;④
层电子数为奇数;④![]() 是形成化合物种类最多的元素;⑤
是形成化合物种类最多的元素;⑤![]() 原子
原子![]() 轨道的电子数为4。请回答下列问题:
轨道的电子数为4。请回答下列问题:
(1)写出一种![]() 元素形成氢化物的化学式_____________。
元素形成氢化物的化学式_____________。
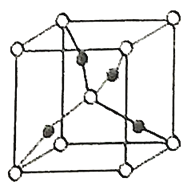
(2)在1个由![]() 与
与![]() 形成的
形成的![]() 晶胞中(结构如图所示)所包含的
晶胞中(结构如图所示)所包含的![]() 原子数目为____________个。
原子数目为____________个。
(3)在[F(NH3)4]2+离子中,![]() 的空轨道接受
的空轨道接受![]() 的氮原子提供的__________形成配位键。
的氮原子提供的__________形成配位键。
(4)常温下![]() 、
、![]() 和氢元素按原子数目1:1:2形成的气态常见物质
和氢元素按原子数目1:1:2形成的气态常见物质![]() 是__________(写名称),
是__________(写名称),![]() 物质分子中
物质分子中![]() 原子轨道的杂化类型为__________,
原子轨道的杂化类型为__________,![]() 分子中
分子中![]() 键的数目为__________
键的数目为__________![]() 。
。
(5)![]() 、
、![]() 、
、![]() 三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
三种元素的第一电离能数值由小到大的顺序为__________(写元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图a是1 mol NO2和1 mol CO恰好反应生成CO2和NO过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的NO2 和CO,反应中的CO和NO的浓度随时间变化的示意图如b图。根据图意回答下列问题:
a 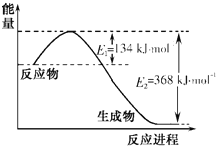 b
b
(1)写出NO2和CO反应的热化学方程式_____________________________________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=_____________。
(3)此温度下该反应的平衡常数K=___________。
(4)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到相应实验目的的是
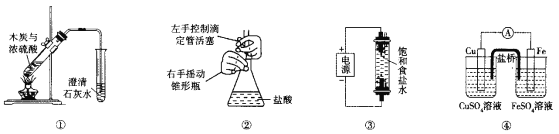
A.装置①用于验证反应是否有CO2生成
B.装置②用于用标准NaOH溶液测定盐酸浓度
C.装置③用于制备少量含NaClO的消毒液
D.装置④用于比较铜、铁活泼性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
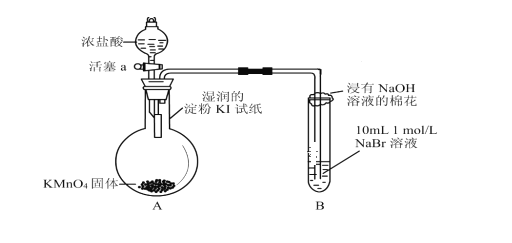
实验时打开弹簧夹,打开活塞a,滴加浓盐酸,使浓盐酸与酸性KMnO4反应。
(1)验证氯气的氧化性强于碘的实验现象是___________________。
(2)B中溶液发生反应的离子方程式是___________。
(3)反应完全后,可往B中加入CCl4来分离提纯,该实验过程名称为________。
(4)实验室制氯气通常使用浓盐酸与二氧化锰在加热的条件下反应,试写出该反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氯化铵溶液呈酸性:NH4+![]() NH3+H+
NH3+H+
B.氢硫酸的电离:H2S ![]() 2H++S2-
2H++S2-
C.向小苏打溶液中加入醋酸溶液:HCO3- +H+= CO2↑+H2O
D.在标准状况下,向 10mL0.1mol/FeBr2溶液中通入22.4 mLCl2:2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com