
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
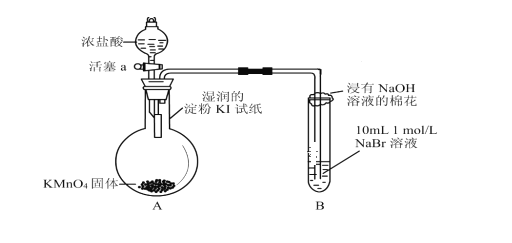
实验时打开弹簧夹,打开活塞a,滴加浓盐酸,使浓盐酸与酸性KMnO4反应。
(1)验证氯气的氧化性强于碘的实验现象是___________________。
(2)B中溶液发生反应的离子方程式是___________。
(3)反应完全后,可往B中加入CCl4来分离提纯,该实验过程名称为________。
(4)实验室制氯气通常使用浓盐酸与二氧化锰在加热的条件下反应,试写出该反应的化学方程式____________________。
【答案】湿润的淀粉碘化钾试纸变蓝 Cl2+2Br-=2Cl-+Br2 萃取分液 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
【解析】
(1)验证氯气的氧化性强于碘的实验是氯气与湿润的淀粉碘化钾反应。
(2)B中溶液发生反应为氯气与NaBr反应。
(3)反应完全后,可往B中加入CCl4来分离提纯,该实验可从溶液中提取溴。
(4)实验室制氯气通常使用浓盐酸与二氧化锰在加热的条件下反应,该反应生成MnCl2、Cl2和H2O。
(1)氯气与碘化钾反应:Cl2+2KI=2KCl+I2,生成的I2使淀粉变蓝。答案为:湿润的淀粉碘化钾试纸变蓝;
(2)B中溶液发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2。答案为:Cl2+2Br-=2Cl-+Br2;
(3)反应完全后,可往B中加入CCl4来分离提纯,该实验可从溶液中提取溴,该实验过程名称为萃取分液。答案为:萃取分液;
(4)实验室制氯气通常使用浓盐酸与二氧化锰在加热的条件下反应,该反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O。答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】化学计量是化学学习中的重要工具,请根据物质的量有关知识填空(NA表示阿伏伽德罗常数)
(1) _____molCO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)标准状况下,体积为11.2L的N2的质量是_____g,所含质子数目为___。
(3)0.2L0.5mol/LAl2(SO4)3溶液和0.5L 0.5mol/L Na2SO4溶液,所含SO42—离子的物质的量浓度之比为____。
(4)标准状况下,NH3和CH4组成的混合气体的密度为0.75g/L,则NH3的体积分数为___。
(5)标准状况下,将VLA气体(摩尔质量为M g/ mol )溶于0.1L水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是_______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用___________mL量筒最好。
②配制时所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有:___________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足
B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是 ( )
A.金刚石的一个晶胞中含有6个碳原子。
B.12 g石墨中六元环的数目为0.5NA。
C.1个干冰晶胞的质量为![]() ×44 g。
×44 g。
D.以面心立方最密堆积形成的晶胞中金属含有4个金属原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(密度为1.84g·cm-3)配制成浓度为0.5mol·L-1的稀硫酸480mL。
(1)选用的主要仪器有:量筒、玻璃棒、胶头滴管、烧杯、_______。
(2)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4 B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至刻度线 D.洗净所用仪器
E.稀释浓H2SO4 F.将溶液转入容量瓶
其操作正确的顺序依次为_______。
(3)简要回答下列问题:
①所需浓硫酸的体积为_______mL。
②如果实验室有15mL、20mL、50mL的量筒应选用_____mL的量筒最好,量取时发现量筒不干净用水洗净后直接量取将使浓度____(“偏高”、“偏低”、“无影响”)。
③将浓硫酸沿烧杯内壁慢慢注入盛水的烧杯中,并用玻璃棒不断搅拌的目的是_____,若搅拌过程中有液体溅出结果会使浓度偏______。
④在转入容量瓶前烧杯中液体应______,否则会使浓度偏_______;并洗涤烧杯和玻璃棒2~3次,洗涤液也要转入容量瓶,否则会使浓度_______。
⑤定容时必须使溶液凹液面与刻度线相切,若俯视会使浓度_____;仰视则使浓度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 1.2 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 1.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20 g NaOH固体溶于水配成100 mL溶液,其密度为1.185 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为______mol·L-1。
(2)从该溶液中取出10 mL,其中NaOH的物质的量浓度为_____ mol· L-1,含NaOH的物质的量为______mol。
(3)将取出的10 mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1 mol·L-1,稀释后溶液体积为___ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成,d能使品红溶液褪色,e是液体,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )
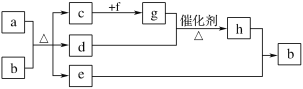
A.二元化合物沸点:e>d>c
B.简单氢化物的稳定性:Q>Y>X
C.元素的非金属性:Y>X>W
D.原子半径的大小:Z>Q>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com