
【题目】化学计量是化学学习中的重要工具,请根据物质的量有关知识填空(NA表示阿伏伽德罗常数)
(1) _____molCO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)标准状况下,体积为11.2L的N2的质量是_____g,所含质子数目为___。
(3)0.2L0.5mol/LAl2(SO4)3溶液和0.5L 0.5mol/L Na2SO4溶液,所含SO42—离子的物质的量浓度之比为____。
(4)标准状况下,NH3和CH4组成的混合气体的密度为0.75g/L,则NH3的体积分数为___。
(5)标准状况下,将VLA气体(摩尔质量为M g/ mol )溶于0.1L水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为____mol/L。
【答案】1.5 14 7NA 3:1 80% ![]() 1
1
【解析】
根据物质的量及阿伏伽德罗常数的意义进行分析计算,根据溶液中溶质的组成进行有关物质的量浓度的相关计算。
(1)![]() ,则n(CO2)=1/2 n(H2O)=1/23mol=1.5mol,故答案为:1.5;
,则n(CO2)=1/2 n(H2O)=1/23mol=1.5mol,故答案为:1.5;
(2)![]() ,
,![]() ,氮原子中质子数等于核电荷数等于7,则所含质子总数为720.5molNA=7NA,故答案为:14;7NA;
,氮原子中质子数等于核电荷数等于7,则所含质子总数为720.5molNA=7NA,故答案为:14;7NA;
(3)0.5mol/LAl2(SO4)3溶液中c(SO42-)=0.5mol/L3=1.5mol/L,0.5mol/L Na2SO4溶液中c(SO42-)=0.5mol/L,则浓度之比为1.5mol/L:0.5mol/L=3:1,故答案为:3:1;
(4)混合气体的平均摩尔质量![]() ,则
,则![]() ,解得
,解得![]() ,则NH3的体积分数为
,则NH3的体积分数为![]() ,故答案为:80%;
,故答案为:80%;
(5)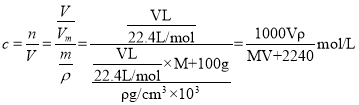 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内的气体是( )
① CO、O2 ② Cl2、CH4 ③ NO2、O2 ④ N2、H2
A.①②B.②C.③④D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__。
②请写出CO和NO生成无污染气体的热化学方程式为__。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
①下列说法正确的是__。
A.实验2容器内压强比实验1的小
B.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
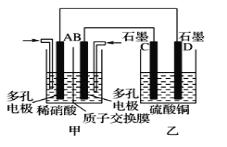
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__(填化学式);A电极的电极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电解质溶液的导电能力与离子浓度和离子所带电荷数均呈正相关。在两份等物质的量浓度且等体积的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是( )
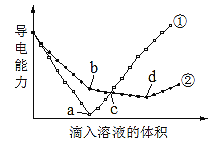
A.①代表滴加NaHSO4溶液的变化曲线
B.反应到b点时,过滤,向滤液中滴加溶液,发生反应的离子方程式为![]()
C.c点两溶液导电能力相同,所以两溶液中含有等物质的量浓度的OH—
D.a点对应的溶液显中性,d点对应的溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素A形成气态的A2分子共有3种,其分子量分别为158、160、162,此三种分子的物质的量之比为7:10:7,则下列说法正确的是( )
A.该元素具有三种同位素
B.A的一种同位素的质量数为80
C.三种分子的平均相对分子质量为159
D.A的各种同位素的原子个数百分组成相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.![]() 离子中心原子上的孤电子对数是1,立体构型为平面三角形
离子中心原子上的孤电子对数是1,立体构型为平面三角形
B.元素周期表第三周期主族元素中,简单离子半径最小的是![]()
C.金刚石转化为石墨为放热反应,说明相同条件下石墨比金刚石稳定
D.![]() 、
、![]() 都是非极性分子
都是非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
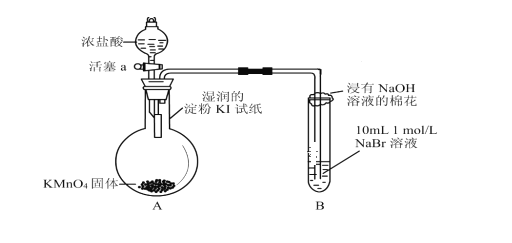
实验时打开弹簧夹,打开活塞a,滴加浓盐酸,使浓盐酸与酸性KMnO4反应。
(1)验证氯气的氧化性强于碘的实验现象是___________________。
(2)B中溶液发生反应的离子方程式是___________。
(3)反应完全后,可往B中加入CCl4来分离提纯,该实验过程名称为________。
(4)实验室制氯气通常使用浓盐酸与二氧化锰在加热的条件下反应,试写出该反应的化学方程式____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com