
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】下列关于含氯消毒剂的解释不正确的是
A. 室温下,氯气通入NaOH溶液中制得漂白液 Cl2+2OH-=Cl-+ClO-+H2O
B. 氯水具有杀菌消毒作用:Cl2+H2O=HCl+HClO
C. 氯水应避光保存的原因是:2HClO![]() H2O+Cl2↑
H2O+Cl2↑
D. 向Ca(ClO)2溶被中通入造量CO2可增强漂白效果:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 在透明溶液中:Cu2+、Mg2+、SO42-、Cl-
B. 加入铝粉产生H2的溶液中:Ba2+、Fe2+、HCO3-、NO3-
C. NaAlO2溶液中:Cu2+、Al3+、Cl-、CO32-
D. 常温下AG=lg![]() =12的溶液中:Na+、K+、S2O32-、SO42-
=12的溶液中:Na+、K+、S2O32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向体积为 10 mL 的 0.1 mol/LNaOH溶液中逐滴加入0.1mol/LCH3COOH溶液,曲线如图所示。下列有关离子浓度关系的比较中,错误的是
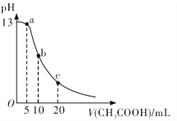
A. a点处:c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b点处:c(CH3COOH)+c(H+ )=c(OH-)
C. c点处:c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH溶液和CH3COOH溶液以任意比混合时:c( Na+)+c(H+)=c(OH-)+(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平),下列说法正确的是

A. 反应物微粒是S、SO3-、OH-
B. 该反应说明S2-和SO32-可以在碱性溶液中可以大量共存
C. 氧化剂与还原剂的物质的量之比为1:2
D. 3molS参加反应时,转移的电子数3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,其中N的化合价为________,是_____________(用“电解质”或者“非电解质”填空)。NaN3受热分解产生N2和Na,则该反应方程式为: ________。已知常温常压下气体摩尔体积为24.5L/mol,则在常温常压下,反应130g NaN3能产生_____________L的N2。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为________________(已知该反应为置换反应)。若已知2.3gNa完全反应,转移的电子物质的量为____________。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KC1和Na2O,请用单线桥表示该反应电子转移:KClO4+8Na= KCl+4Na2O_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
B. 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O![]()
![]() +OH
+OH
C. 由Na和C1形成离子键的过程:![]()
D. 电解精炼铜的阴极反应:Cu2+ +2e![]() Cu
Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院官微曾给出灰霾中细颗粒物的成因,部分分析如下图所示。

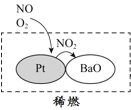
(1)根据如图信息可以看出,所列的气体污染物并非由机动车行驶造成的是______。汽车发动机废气稀燃控制系统主要工作原理如上右图所示;写出稀燃过程中NO发生的主要反应的方程式_____________________________________。
(2)农业活动排出的氨可能是施用的化肥分解,也可能是施用不当导致的。比如某些氮肥与碱性肥料混合施用会释出氨,用离子方程式解释________________________。
(3)经过研究发现我国的霾呈中性,其主要原因如下图所示,A的化学式是________。
2NH3(气)+SO2(气)+2NO2(气)![]() 2NH4+(溶液)+A(溶液)+2HONO(气)
2NH4+(溶液)+A(溶液)+2HONO(气)
(4)煤燃烧排放的烟气含有SO2和NOx,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有SO2和NOx的烟气通入盛有NaClO2溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如下(其他极微量离子忽略不计):
离子 | Na+ | SO42- | NO3- | H+ | Cl |
浓度/(mol·L1) | 5.5×103 | 8.5×104 | y | 2.8×104 | 3.5×103 |
①NO和NaClO2溶液反应的离子方程式是___________________。
②表中y=_______。
(5)工业生产硝酸也有可能产生NOx污染。请写出硝酸生产中的第一步:氨的催化氧化的化学方程式___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com