
【题目】某元素A形成气态的A2分子共有3种,其分子量分别为158、160、162,此三种分子的物质的量之比为7:10:7,则下列说法正确的是( )
A.该元素具有三种同位素
B.A的一种同位素的质量数为80
C.三种分子的平均相对分子质量为159
D.A的各种同位素的原子个数百分组成相同
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界______。
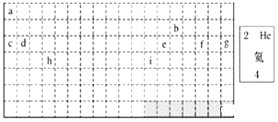
(2)表中所列元素,属于短周期元素的有______(用元素符号回答),属于主族元素的有______(用元素符号回答)。
(3)g元素位于第______周期第______族;i元素位于第______周期第______族。
(4)元素f是第______周期第______族元素,请按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量_________。
(5)写出b元素的基态原子的电子排布式______,写出h元素的符号______,该原子的价层电子排布图______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,是一种复盐(又称摩尔盐)。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体,三种盐的溶解度(单位为g/100gH2O)见下表:
温度℃ | FeSO4·7H2O | (NH4)2SO4 | (NH4)2SO4·FeSO4·6H2O |
10 | 20.0 | 73.0 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78.0 | 28.1 |
实验用品:10%Na2CO3溶液、Fe屑、3molH2SO4、(NH4)2SO4、蒸馏水、无水乙醇。实验步骤流程如图所示:
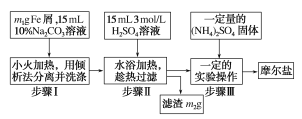
(1)步骤Ⅰ加入10%Na2CO3溶液的作用是__。
(2)下列情况适合倾析法的有__。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤Ⅲ中加入(NH4)2SO4后要得到摩尔盐晶体,需要经过的实验操作包括加热蒸发、__、__。
(4)得到的晶体需要用乙醇洗涤的目的是__。
(5)已知摩尔盐晶体在100℃~110℃时分解,分解的产物中除固体外,还可能含有SO3(g)、SO2(g)及N2(g)。甲同学用如图所示装置设计实验,探究摩尔盐晶体加热分解时可能产生的气体产物。
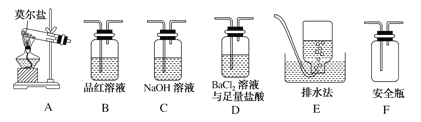
①甲同学的实验中,装置依次连接的合理顺序为:A→F→(____________)→(____________)→C→E。
②证明含有SO3的实验现象是__。
(6)为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。通过测定NH4+设计实验装置如图所示。取25.00mL样品溶液进行该实验。
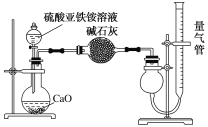
①该方案中量气管中最佳试剂是__。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和食盐水
②该方案中收集完气体并恢复至室温,读数前应进行的操作是__。
③设该样品中NH4+完全转化为NH3且忽略溶解损耗,测得NH3的体积为VL(已折算为标准状况下),则该摩尔盐样品中硫酸亚铁铵纯度为__(用含m、V的代数式表示,(NH4)2SO4·FeSO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
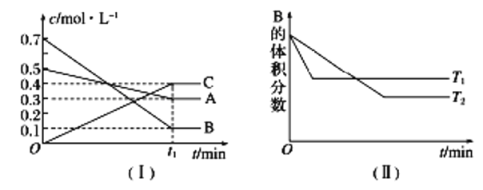
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为________,正反应为_____(填“吸热”或“放热”)反应。
(2)t1 min后,改变下列某一条件,能使平衡向逆反应方向移动的有______(填字母序号)。
A.保持其他条件不变,增大压强
B.保持容器总体积不变,通入少量稀有气体
C.保持其他条件不变,升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学计量是化学学习中的重要工具,请根据物质的量有关知识填空(NA表示阿伏伽德罗常数)
(1) _____molCO2中含有氧原子数跟1.806×1024个H2O分子含有的氧原子数相同。
(2)标准状况下,体积为11.2L的N2的质量是_____g,所含质子数目为___。
(3)0.2L0.5mol/LAl2(SO4)3溶液和0.5L 0.5mol/L Na2SO4溶液,所含SO42—离子的物质的量浓度之比为____。
(4)标准状况下,NH3和CH4组成的混合气体的密度为0.75g/L,则NH3的体积分数为___。
(5)标准状况下,将VLA气体(摩尔质量为M g/ mol )溶于0.1L水中,所得溶液的密度为ρg/cm3,则此溶液的物质的量浓度为____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基钠(NaNH2)常用作有机合成的促进剂,是合成维生素 A 的原料。某学习小组用如下装置,以NH3和Na为原料加热至 350-360 ℃制备氨基钠,并检验其生成的产物和测定产品的纯度。
已知:NaNH2极易水解且易被空气氧化。回答下列问题 :
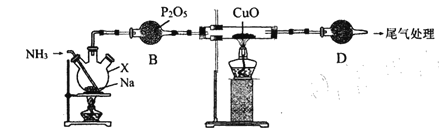
A C
(1)仅从试剂性质角度分析,下列各组试剂不宜用于实验室制备NH3的是________(填字母序号)。
A.浓氨水、CaO B. NH4Cl固体、Ca(OH)2固体
C.浓氨水 D.NH4NO3固体 、NaOH固体
(2)仪器D名称为___________,其中盛放的试剂为 ___________。
(3)装置A中发生反应的化学方程式为 __________,能证明装置A中已发生反应的实验依据是__________________________ 。
(4) 装置B的作用是______________ 。
(5) 制备时,通入的氨气过量,待钠充分反应后,取 mg 产品, 按如图装置进行实验(产品所含杂质仅为 Na2O )。
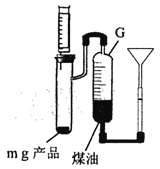
用注射器向试管中缓慢加入H2O至恰好完全反应立即停止,G中液面从刻度V1变 为 V2(已知V2>Vi,单位 mL,忽略固体体积,读取刻度时保持两使液面相平,实验过程处于标准状况下),则产品纯度为________:若读取V1时,G中液面低于漏斗侧液面,则所测得的纯度比实际产品纯度_________(填“偏高”、“ 偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应是________热反应,且a+b________p(填“>”“<”或“=”)。
(2)减压时,A的质量分数________(填“增大”“减小”或“不变”,下同),正反应速率________,逆反应速率________。
(3)若加入B(体积不变),则A的转化率________,B的转化率________。
(4)若升高温度,则平衡时,B、C的浓度之比![]() 将________。
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量________。
(6)若B是有色物质,A、C均为无色物质,则加入A(体积不变)时混合物的颜色________,加入C(体积不变)时混合物的颜色________,而维持容器内气体的压强不变,充入氖气时,混合物的颜色_______(填“变浅”“变深”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.向沸水中滴加FeCl3溶液制备胶体: Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.在H2SO4溶液中滴入Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.钠与CuSO4溶液反应:2Na+Cu2+=Cu +2Na+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:还原性强弱:I->Fe2+。往100 mL碘化亚铁溶液中缓慢通入3.36 L(标准状况)氯气,反应完成后溶液中有一半的Fe2+被氧化成Fe3+。则原碘化亚铁溶液的物质的量浓度为
A. 1.2 mol·L-1 B. 1.5 mol·L-1 C. 1.0 mol·L-1 D. 1.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com