
【题目】下列叙述不正确的是 ( )
A.金刚石的一个晶胞中含有6个碳原子。
B.12 g石墨中六元环的数目为0.5NA。
C.1个干冰晶胞的质量为![]() ×44 g。
×44 g。
D.以面心立方最密堆积形成的晶胞中金属含有4个金属原子。
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下图是某品牌饮用矿泉水标签的部分内容。下列说法正确的是

A. 标签上离子的浓度是物质的量浓度
B. 由矿泉水制蒸馏水必需使用的玻璃仪器有:圆底烧瓶、酒精灯、温度计、冷凝管、牛角管和锥形瓶
C. 该品牌饮用矿泉水中c(Mg2+)最大值为2×10-4mol/L
D. 一瓶该品牌饮用矿泉水中SO42-的物质的量不超过l×10-5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时反应为:Fe + Ni2O3 +3H2O![]() Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
Fe(OH)2 +2Ni(OH)2 ,下列推断不正确的是( )
A.放电时,负极上的电极反应式是:Fe+2OH--2e-=Fe (OH)2
B.放电时,每转移2 mol 电子,正极上有1 mol Ni2O3 被氧化
C.充电时,阳极上的电极反应式是:2Ni(OH)2 -2e-+ 2OH- = Ni2O3 +3H2O
D.该蓄电池的电极必须是浸在某种碱性电解质溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图a是1 mol NO2和1 mol CO恰好反应生成CO2和NO过程中的能量变化示意图;现往体积固定的密闭容器中通入等物质的量的NO2 和CO,反应中的CO和NO的浓度随时间变化的示意图如b图。根据图意回答下列问题:
a 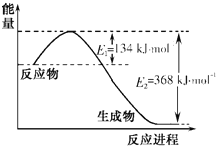 b
b
(1)写出NO2和CO反应的热化学方程式_____________________________________。
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=_____________。
(3)此温度下该反应的平衡常数K=___________。
(4)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g)△H<0。试回答下列问题:
CO2(g)+H2(g)△H<0。试回答下列问题:
①若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=____________。
②在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5mol·L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)____v(逆)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到相应实验目的的是
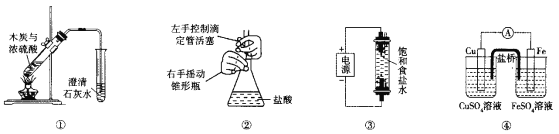
A.装置①用于验证反应是否有CO2生成
B.装置②用于用标准NaOH溶液测定盐酸浓度
C.装置③用于制备少量含NaClO的消毒液
D.装置④用于比较铜、铁活泼性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关气体体积的叙述正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数也不同
D.气体摩尔体积指1mol任何气体所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
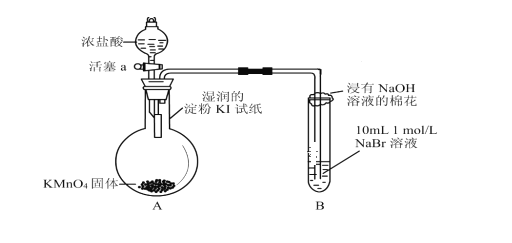
实验时打开弹簧夹,打开活塞a,滴加浓盐酸,使浓盐酸与酸性KMnO4反应。
(1)验证氯气的氧化性强于碘的实验现象是___________________。
(2)B中溶液发生反应的离子方程式是___________。
(3)反应完全后,可往B中加入CCl4来分离提纯,该实验过程名称为________。
(4)实验室制氯气通常使用浓盐酸与二氧化锰在加热的条件下反应,试写出该反应的化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将1.0 L w mol·L-1的CH3COOH溶液与0.1 mol的NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体。溶液pH随通(加)入HCl或NaOH的物质的量的变化如下图。下列叙述正确的是 ( )
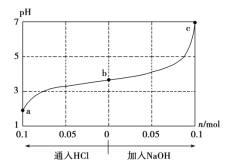
A.a、b、c对应的混合液中,水的电离程度由大到小的顺序是a>b>c
B.若忽略体积变化,则25 ℃时,CH3COOH的电离平衡常数K=![]() ×10-7 mol·L-1
×10-7 mol·L-1
C.加入NaOH过程中,![]() 逐渐减小
逐渐减小
D.加入NaOH过程中,c(Na+)·c(CH3COO-)逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。在一定温度下,氧化铁可以与一氧化碳发生下列反应:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)
(1)该温度下,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,10 min后,生成了单质铁11.2 g。则10 min内CO的平均反应速率为_________。
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态:
①____________________________________________________;
②_____________________________________________________。
(3)某些金属氧化物粉末和铝粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是___________________。
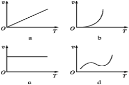
(4)写出氢氧化铝在水中发生碱式电离的电离方程式:___________________欲使上述体系中铝离子浓度增加,可加入的物质是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com