
【题目】下列离子方程式正确的是( )
A.氯化铵溶液呈酸性:NH4+![]() NH3+H+
NH3+H+
B.氢硫酸的电离:H2S ![]() 2H++S2-
2H++S2-
C.向小苏打溶液中加入醋酸溶液:HCO3- +H+= CO2↑+H2O
D.在标准状况下,向 10mL0.1mol/FeBr2溶液中通入22.4 mLCl2:2Fe2++2Br-+2Cl2 =2Fe3++Br2+4Cl-
【答案】D
【解析】
A.氯化铵溶液呈酸性的原因,是弱离子的水解,离子方程式为:NH4++H2ONH3H2O+H+,故A错误;
B.氢硫酸的电离分步进行,主要以第一步为主,其正确的电离方程式为:H2SH++HS-,故B错误;
C.向小苏打溶液中加入醋酸溶液生成醋酸钠、二氧化碳气体和水,正确的离子方程式为:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-,故C错误;
D.10 mL 0.1 molL-1FeBr2溶液中含有0.001molFeBr2,含有0.001mol亚铁离子、0.002mol溴离子,标准状况下22.4mL氯气的物质的量为0.001mol,亚铁离子优先被氧化,0.001mol亚铁离子完全反应消耗0.0005mol氯气,剩余的0.0005mol氯气能够氧化0.001mol溴离子,则反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故D正确。
故答案选D。


科目:高中化学 来源: 题型:
【题目】下图表示实验室某浓盐酸试剂瓶上的标签,试根据标签上的有关数据回答下列问题

(1)该浓盐酸的物质的量浓度为______mol·L-1。
(2)取用任意体积的该浓盐酸时,下列物理量中不随所取体积的多少而变化的是_______(填字母代号)。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取_________mL(保留一位小数)上述浓盐酸进行配制。如果实验室有5mL、10mL、50mL量筒,应选用___________mL量筒最好。
②配制时所需仪器除了量筒、烧杯、玻璃棒外,还需要的仪器有:___________。
③下列情况会导致所配溶液的浓度偏低的是__________(填字母代号)。
A.浓盐酸挥发,浓度不足
B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将20 g NaOH固体溶于水配成100 mL溶液,其密度为1.185 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为______mol·L-1。
(2)从该溶液中取出10 mL,其中NaOH的物质的量浓度为_____ mol· L-1,含NaOH的物质的量为______mol。
(3)将取出的10 mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1 mol·L-1,稀释后溶液体积为___ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】围绕下列几种物质:①铝、②Al2O3、③稀硝酸、④H2SO4、⑤Ba(OH)2固体、⑥稀氨水、⑦Al2(SO4)3、⑧NaOH溶液、⑨NaHCO3溶液,按要求回答下列问题:
(1)既能与强酸反应,又能与强碱反应的是_____________(填序号);
(2)属于电解质的是_____________(填序号);
(3)写出最适宜制取Al(OH)3的离子方程式_____________;
(4)两物质间发生反应的离子方程式为H++OH-=H2O,请写出该反应的化学方程式_____________;
(5)写出①和⑧反应的离子方程式________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)![]() xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
xC(g) △H<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是
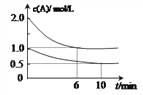
A. x=1
B. 此条件下,该反应的平衡常数K=4
C. 给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D. 甲和乙中B的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 由NO2和N2O4组成的平衡体系加压后颜色先变深后变浅
B. 增大压强可加快SO2转化为SO3的速率
C. 黄绿色的氯水光照后颜色变浅
D. 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成,d能使品红溶液褪色,e是液体,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )
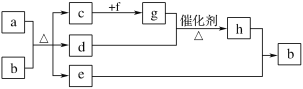
A.二元化合物沸点:e>d>c
B.简单氢化物的稳定性:Q>Y>X
C.元素的非金属性:Y>X>W
D.原子半径的大小:Z>Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的转化可储存太阳能,例如四环烷(QDC)与降冰片二烯(NBD)之间的相互转化,反应过程中的能量变化如图所示。

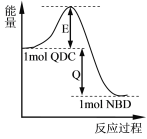
以下叙述中错误的是( )
A.QDC和NBD互为同分异构体
B.相同条件下,NBD比QDC稳定
C.QDC转变为NBD的过程中可以储存太阳能
D.上述转化过程中加入催化剂,对于图中Q的大小没有影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com