
| A. | ①Na,K,Rb ②N,P,As ③O,S,Se ④Na,P,Cl元素的电负性随原子序数增大而递增的是④ | |
| B. | 下列原子中,①1s22s22p63s23p1②1s22s22p63s23p2③1s22s22p63s23p3④1s22s22p63s23p4对应的第一电离能最大的是④ | |
| C. | 某元素的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,该元素在第三周期第 IIA族 | |
| D. | 以下原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22 s22p63s23p4半径最大的是① |
分析 A、同周期自左而右电负性增大,同主族自上而下电负性减小;
B、同周期随原子序数增大第一电离能呈增大趋势,ⅤA族3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
C、该元素第三电离能剧增,最外层应有2个电子,表现+2价;
D、同周期自左而右原子半径减小,同主族自上而下原子半径增大.
解答 解:A、同周期自左而右电负性增大,同主族自上而下电负性减小,故①Na、K、Rb电负性依次减小,②O、S、Se的电负性依次减小 ③Na、P、Cl的电负性依次增大,故A正确;
B、同周期随原子序数增大第一电离能呈增大趋势,ⅤA族3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能,③>④>②>①,故B错误;
C、该元素第三电离能剧增,最外层应有2个电子,表现+2价,处于第IIA族,故C正确;
D、核外电子排布:①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4,则①为Si、②为N、③为C、④为S,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Si>C>N,Si>S,故Si原子半径最大,即①的原子半径最大,故D正确;故选B.
点评 本题考查核外电子排布、微粒半径比较、电离能与电负性等,难度中等,注意理解电离能与元素化合价关系、同周期第一电离能发生突跃原理.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 该硫酸的物质的量浓度为9.2mol/L | |
| B. | 1molZn与足量的该硫酸反应产生2g氢气 | |
| C. | 配制200mL4.6mol/L的稀硫酸需取该硫酸50 mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL含9.5g MgCl2的溶液 | |
| B. | 31g Na2O溶于水配成1L溶液 | |
| C. | 4%的H2SO4溶液(ρ=1.025g•cm-3) | |
| D. | 213mL 0.5mol•L-1盐酸和82mL 0.5mol•L-1盐酸的混合液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 现象记录 |
| 1 | 将1g细铜丝放入盛有10mL1mol•L-1HNO3的试管中加热 | 铜丝表面有无色气体逸出,溶液变成天蓝色 |
| 2 | 将1g细铜丝放入盛有10mL的14mol•L-1HNO3的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色. |
| 3 | 将硝酸铜晶体配成饱和溶液 | 深蓝色溶液 |
| 4 | 向饱和的硝酸铜溶液中不断滴加14mol•L-1HNO3 | 溶液仍呈深蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有分子的数目为0.5NA | |
| B. | 1mol/L CH3COOH溶液中含有CH3COOH分子的数目为NA | |
| C. | 78g 苯中含有碳碳双键的数目为3NA | |
| D. | 10g46%的乙醇水溶液中所含氢原子数目为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
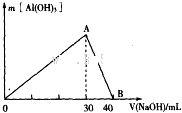 研究工业废弃物的处理和防治具有重要的意义.
研究工业废弃物的处理和防治具有重要的意义.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
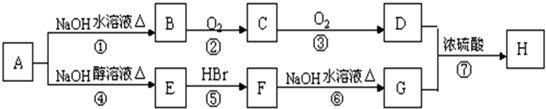
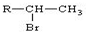 (R为烃基)
(R为烃基)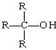 不能发生催化氧化反应.
不能发生催化氧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com