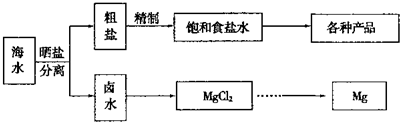
海水中蕴藏着丰富的资源.海水综合利用的流程图如下:
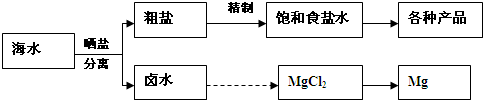
粗盐各种产品卤水MgCl
2Mg晒盐分离海水精制饱和食盐水
(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是
.
②实验室用惰性电极电解100mL NaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为
12
12
(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84”消毒液,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式
.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl
2粗产品.从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)
2沉淀;
c.在Mg(OH)
2沉淀中加入盐酸得到MgCl
2溶液,再经蒸发结晶得到MgCl
2?6H
2O;
d.将MgCl
2?6H
2O在一定条件下加热得到无水MgCl
2;
e.电解熔融的氯化镁可得到Mg.
①步骤d中的“一定条件”指的是
氯化氢气流中
氯化氢气流中
,目的是
抑制Mg2+水解
抑制Mg2+水解
.
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点
e步电解产生的Cl2用于制取HCl气体,利用抑制d步中MgCl2水解,并制得c步中所需用盐酸
e步电解产生的Cl2用于制取HCl气体,利用抑制d步中MgCl2水解,并制得c步中所需用盐酸
.
③有同学认为:步骤b后可加热Mg(OH)
2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你同意该同学的想法吗?
不同意
不同意
,请说出你同意或不同意的理由
因为MgO熔点很高,熔融时会消耗大量的电能而增加生产成本.
因为MgO熔点很高,熔融时会消耗大量的电能而增加生产成本.
.