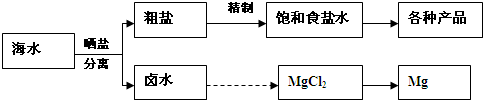
Ⅰ海水中蕴藏着丰富的资源.海水综合利用的流程图如下.
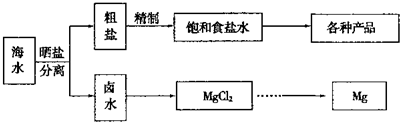
用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是
.
②实验室用惰性电极电解500mL0.1mol/LNaCl溶液,若阴阳两极共得到112mL气体(标准状况),则所得溶液的pH为
12
12
(忽略反应前后溶液的体积变化)
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的总化学方程式:
.
Ⅱ铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的Al
2O
3和SiO
2,用如图所示的装置(甲、乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用稀硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:
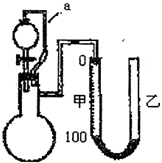
(1)装置中导管a所起的作用是
平衡气压,使分液漏斗中的液体顺利滴下
平衡气压,使分液漏斗中的液体顺利滴下
.
(2)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意
AD
AD
.
A.反应前后读取甲管液面数据时应使甲、乙中液面保持水平
B.反应后读取甲管液面数据时,甲、乙两管液面无须保持水平
C.反应后立即读取甲管液面数据,防止液面变动
D.反应后静置一会,需待反应器恢复原来温度
(3)若从稀硫酸和氢氧化钠溶液中挑选一种试剂,你选择的试剂是
NaOH溶液
NaOH溶液
,不选择另一种试剂的理由是
由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差
由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差
.