
【题目】阿魏酸是用于治疗心脑血管疾病及白细胞减少等症药品的基本原料。下面是以石炭酸为原料制备阿魏酸的一种合成路线:
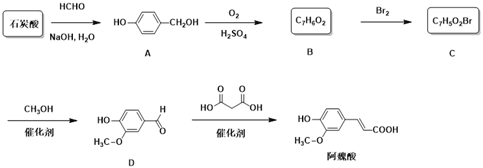
(1)由石炭酸生成A和A生成B的反应类型分别为____、______。
(2)阿魏酸有顺式和反式两种结构,其顺式结构的结构简式为________。
(3)C中官能团名称为__________。
(4)由B生成C的化学反应方程式为___________________。
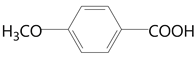
(5)芳香化合物E是D的同分异构体,0.1 mol E能与饱和碳酸氢钠溶液反应放出4.4g CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为2∶2∶1∶3,写出符合要求的E的结构简式____________。
(6)由谷维素(![]() )也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
)也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
【答案】 加成反应、氧化反应 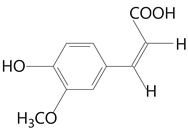 溴原子、羟基、醛基
溴原子、羟基、醛基 ![]()
![]()
![]()

![]()
【解析】石炭酸是苯酚的俗称,第一步反应是苯酚羟基对位上的氢原子对甲醛的碳氧双键进行加成得到A(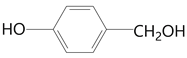 )。从A到B的过程中应该少了2个H,所以是氧化反应,根据D的结构简式,确定酚羟基应该没有被氧化,所以是醇被氧化为醛,得到B为
)。从A到B的过程中应该少了2个H,所以是氧化反应,根据D的结构简式,确定酚羟基应该没有被氧化,所以是醇被氧化为醛,得到B为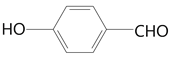 ;B和单质溴应该发生取代反应,根据D中取代基的位置得到C为
;B和单质溴应该发生取代反应,根据D中取代基的位置得到C为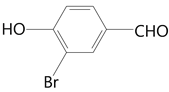 ;C与甲醇发生取代反应脱去一分子HBr得到D(
;C与甲醇发生取代反应脱去一分子HBr得到D(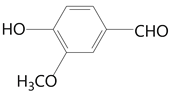 ),最后D与丙二酸作用得到阿魏酸。
),最后D与丙二酸作用得到阿魏酸。
(1)由上,石炭酸生成A的反应是加成反应,A生成B的反应是氧化反应。
(2)顺式结构的要求是由相同基团在双键的同侧,所以结构应该为 。
。
(3)C为 ,其中的官能团为溴原子、羟基和醛基。
,其中的官能团为溴原子、羟基和醛基。
(4)B生成C是发生的取代反应,方程式为![]()
(5)D的分子式为C8H8O3,不饱和度为5,E的分子式、不饱和度与D相同。0.1 mol E能与饱和碳酸氢钠溶液反应放出4.4g(0.1mol)CO2,说明E中有一个羧基(一个不饱和度),E是芳香化合物,说明E有苯环(4个不饱和度),有4种不同化学环境的氢,峰面积比为2∶2∶1∶3,显然1代表羧基氢,3一定代表甲基氢,所以E中一定有甲基,为了保证4种不同环境的H,取代基在对位,所以结构简式为 。
。
(6)由谷维素(![]() )制备阿魏酸,只需要将酯基水解,转化为羧基即可,所以合成路线为:
)制备阿魏酸,只需要将酯基水解,转化为羧基即可,所以合成路线为:![]() 。对应方程式为:
。对应方程式为:
![]()


科目:高中化学 来源: 题型:
【题目】下列物质属于同系物的是( )
A. ![]() 与
与![]() B. CH3CH2Cl与CH2ClCH2CH2Cl
B. CH3CH2Cl与CH2ClCH2CH2Cl
C. C2H5OH与CH3OH D. CH3CH2CH3与CH2=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能使品红溶液褪色,且褪色原理基本相同的是( )
①活性炭 ②新制氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④
B.②③⑤
C.②④⑤⑥
D.③④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH![]() )/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
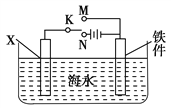
①开关K断开时,且若为生铁,则铁件主要发生_____腐蚀;若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜(含锌等杂质),容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加127 g时,X电极溶解的铜的质量________127 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH= ,此酸的电离平衡常数K= ,由HA电离出的H+的浓度约为水电离出的H+的浓度的 倍。
(2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶剂。向其中加入少量酸或碱时,溶液的酸碱性变化不大。
①向该溶液中加入少量盐酸时,发生反应的离子方程式是 ,向其中加入少量KOH溶液时,发生反应的离子方程式是 。
②现将0.04mol﹒L-1HA溶液和0.02mol﹒L-1NaOH溶液等体积混合,得到缓冲溶液。
a、若HA为HCN,该溶液显碱性,则溶液中c(Na+) c(CN-)(填“<”、“=”或“>”)。
b、若HA为CH3COOH,该溶液显酸性,溶液中所有的离子按浓度由大到小排列的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ实验室里需要纯净的氯化钠溶液,但实验室只有混有硫酸钠、碳酸氢铵的氯化钠.某学生设计了如下方案进行提纯:
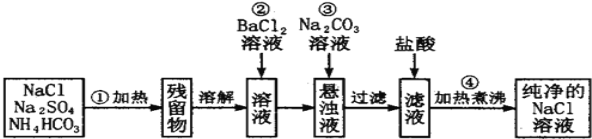
(1)操作②能否改为加硝酸钡溶液,______(填“能”或“否”) ,理由_____________________________。
(2)进行操作②后,如何判断SO42- 已除尽,方法是___________________。
(3)操作④的目的是_______________________________。
Ⅱ硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3mol/L H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中,分离操作,所用到的玻璃仪器有___________________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)在步骤3中,“一系列操作”依次为_____________________、_______________________和过滤。
(3)实验室欲用18mol/L H2SO4来配制240mL 3mol/L H2SO4溶液,需要量取________mL浓硫酸,实验时,下列操作会造成所配溶液浓度偏低的是__________________。(填字母)
a.容量瓶内壁附有水珠而未干燥处理 b.未冷却至室温直接转移至容量瓶中
c.加水时超过刻度线后又倒出 d.定容时仰视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com