
【题目】下列说法正确的是
A. 水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。
B. Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。
C. 常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH![]() )/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。
D. 室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】仔细观察下图,下列叙述错误的是
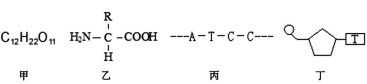
A. 在人体细胞内检测到图甲的化合物可能是乳糖
B. 组成人体的化合物乙的R基种类约有20种
C. 图丙中共有4种含氮碱基,4种脱氧核苷酸
D. 组成图丁中化合物的单糖一定是脱氧核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中四个图像的说法正确的是
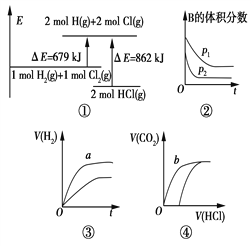
注:图中,E表示能量,p表示压强,t表示时间,y表示体积。
A. ①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol
B. ②表示其他条件不变时,反应4A(g)+3B(g) ![]() 2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。
C. ③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示HCl溶液。
D. ④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:2Fe2O3(s)+3C(s)=3CO2(g)+4Fe(s) ΔH1=+234.1 kJ·mol-1①
C(s)+O2(g=CO2(g) ΔH2=-393.5 kJ·mol-1②
则Fe和O2反应生成Fe2O3的热化学反应方程式为_______________________________。
(2)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①常温下NaHA溶液的pH________(填序号),原因是____________________________。
A.大于7 B.小于7 C.等于7 D.无法确定
②已知常温下H2A的钙盐(CaA)的饱和溶液中存在以下平衡:CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
Ca2+(aq)+A2-(aq) ΔH>0。若要使该溶液中Ca2+浓度变小,可采取的措施有______________________。
A.升高温度 B.降低温度 C.加入NH4Cl晶体 D.加入Na2A固体
(3)实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.65 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.93 | 20.00 |
请完成下列填空:
①滴定达到终点的标志是_____________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为_____________________(保留两位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有________(填字母序号)。
A.滴定终点读数时俯视
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.称量NaOH固体中混有Na2CO3固体
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿魏酸是用于治疗心脑血管疾病及白细胞减少等症药品的基本原料。下面是以石炭酸为原料制备阿魏酸的一种合成路线:
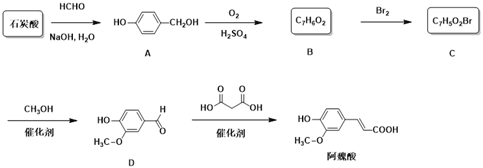
(1)由石炭酸生成A和A生成B的反应类型分别为____、______。
(2)阿魏酸有顺式和反式两种结构,其顺式结构的结构简式为________。
(3)C中官能团名称为__________。
(4)由B生成C的化学反应方程式为___________________。
(5)芳香化合物E是D的同分异构体,0.1 mol E能与饱和碳酸氢钠溶液反应放出4.4g CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为2∶2∶1∶3,写出符合要求的E的结构简式____________。
(6)由谷维素(![]() )也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
)也可制备阿魏酸,请设计简单的合成路线并写出相应的化学反应方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图转化关系中的物质均为常见物质或它们的溶液,其中 A、C 为单质,B 为氧化物且常温下为无色液体,E 为淡黄色固体,H 为红褐色沉淀。(反应条件和部分产物已省略)
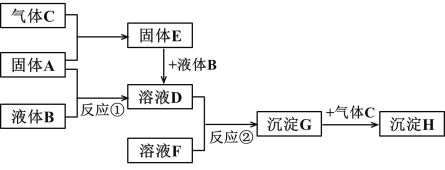
根据上述转化关系,回答问题:
(1)写出下列物质的化学式:A_________ G _________
(2)反应①的化学方程式为:______________________________________。反应②的离子方程式为:______________________________________。
(3)沉淀 G 转化为沉淀 H 的现象:________,化学方程式为___________
(4)写出物质 E 的一种用途________________________________。
(5)一定条件下,将一定量的 A 与足量的 C 充分反应,最终得到 39.0g 固体 E,则反应中转移的电子数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下将35mL气态烷烃完全燃烧,恢复到原来状况下,得到二氧化碳气体140mL,则该烃的分子式为( )
A.C5H12B.C4H10C.C3H6D.C4H8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com